Адреногенитальный синдром у детей
Содержание:
- Причины адреногенитального синдрома
- Каковы причины и патогенез адреногенитального синдрома?
- Симптомы адреногенитального синдрома
- Механизм наследования генитального синдрома
- Симптомы Адреногенитального синдрома:
- Скрининг и другие методы диагностики
- Лечение адреногенитального синдрома.
- Диагностика адреногенитального синдрома у детей
- Профилактика
- Этиология и патогенез первичного гиперальдостеронизма
- Адреногенитальный синдром – симптомы
- Лечение адреногенитального синдрома
- Другие заболевания из группы Болезни мочеполовой системы:
Причины адреногенитального синдрома
В 90-95% случаев патология возникает при повреждении активного гена CYP21-B, который отвечает за синтез 21-гидроксилазы – фермента, влияющего на образование кортизола. В остальных клинических случаях АГС развивается вследствие дефектов ДНК, нарушающих производство других ферментов, обеспечивающих стероидогенез, – StAR/20,22-десмолазы, 3-β- гидрокси-стероиддегидрогеназы, 17-α-гидроксилазы/17,20-лиазы, 11-β-гидроксилазы, P450-оксидоредуктазы и синтетазы альдостерона.
Различают следующие виды адреногенитального синдрома:
-
сольтеряющий тип. Проявления болезни начинают обнаруживаться с первых недель жизни. У девочек половые органы формируются по мужскому типу, а у мальчиков увеличиваются пенис и мошонка. Из-за грубого нарушения образования стероидных гормонов развивается тяжелая рвота, понос, судороги, темнеет кожа. Прогрессирующее обезвоживание ведет к смерти при отсутствии своевременной заместительной терапии.
Через 2-3 дня от начала клинического проявления заболевания появляются симптомы дегидратации и развития метаболического ацидоза.
-
Простой вирильный. Преобладают нарушения развития половых органов. У девочек: увеличен клитор, похожий на половой член; углублен вход во влагалище; половые губы больше нормы; матка и придатки сформированы. У мальчиков: увеличен пенис, кожа мошонки имеет темную пигментацию. Девочки широкоплечие, с узким тазом, укороченными и массивными конечностями. У них низкий голос, кадык на шее, молочные железы не растут. У мальчиков рано появляются грубые волосы на подбородке и верхней губе, ломается голос.
С возрастом у пациентов нарастают признаки вирилизации вследствие стимулирующего действия андрогенов. Характерно ранее начало полового созревания в 3-5 лет.
-
Постпубертатный тип. Выявляют в молодом возрасте. Приобретенная форма возникает после появления опухоли в надпочечниках или при их повышенной активности.
Половые органы соответствуют полу, но развивается гипертрофия клитора и пениса. Основные нарушения встречаются у женщин – уменьшаются или прекращаются месячные (после стресса, травмы, аборта, выкидыша). Наступление первой менструации может быть только к 15 годам, цикл удлинен (более 30-40 дней). Кожа склонна к повышенной жирности и образованию угрей, имеется повышенное оволосение. При обследовании обнаруживают гиперплазию коркового слоя надпочечников.
Также имеются и варианты неклассического течения адреногенитального синдрома – с высоким давлением крови, с лихорадкой, липидный (ожирение, нарушение холестеринового обмена), с гирсутизмом (усиленный рост волос на теле и лице, по средней линии живота, около сосков).
Каковы причины и патогенез адреногенитального синдрома?
Патология обусловлена наследственными мутациями генов, которые приводят к расстройству надпочечной ферментной системы. Чего следует ожидать родителям:
- В случае если заболевание имеется лишь у отца или матери ребенка, указанное нарушение не будет унаследовано младенцем.
- Когда два родителя имеют указанную мутацию, вероятность ее появления у новорожденного – до 25 процентов.
- Если один из родителей страдает от гормонального отклонения, а другой оказывается носителем генной мутации, риск обнаружения патологии у будущего ребенка увеличивается до 75 процентов.
Патогенез (процессы, происходящие во время заболевания) адреногенитального синдрома заключается в чрезмерной выработке гормона андрогена по причине дефицита определенного фермента. При этом аномально снижается процесс продуцирования иных гормонов (кортизола, побуждающего синтез белка, и альдостерона, ответственного за обмен минералов в организме). Степень заболевания определяется интенсивностью секреции (выработки) избыточных веществ.

Гормон андроген
Симптомы адреногенитального синдрома
При врожденной форме адреногенитального синдрома еще в период внутриутробного развития при формировании гормональной функции надпочечников вырабатывается излишнее количество андрогенов. Избыток андрогенов приводит к возникновению половой дифференцировки, относящейся к плоду женского пола. К 9-11 неделе внутриутробного развития плод уже имеет половое строение и органы, характерные для женского организма, хотя наружные половые органы на данном этапе еще только начинают формироваться. При этом женский фенотип формируется из начального типа.
На женский плод и его наружные половые органы оказывает влияние чрезмерная выработка тестостерона, в итоге происходит значительное увеличение полового бугорка, который затем принимает форму пенисообразного клитора, лабиосакральные складки сливаются и по форме напоминают мошонку. Урогенитальный синус открывается под деформированным клитором, не распределяясь изначально на влагалище и уретру. Поэтому при рождении ребенка зачастую неправильно определяют его половую принадлежность. Так как гонады яичники приобретают женскую форму, врожденный адреногенитальный синдром нередко называют ложным женским гермафродитизмом, в период внутриутробного развития гиперпродукция андрогенов приводит к гиперплазии надпочечников.
Дети, страдающие таким заболеванием, нуждаются в постоянном контроле со стороны детских эндокринологов. Современные медицинские методики предусматривают своевременное хирургическое лечение адреногенитального синдрома, чтобы операционным путем произвести коррекцию пола и в дальнейшем ребенок развивался по женскому типу. Сейчас к гинекологам-эндокринологам нередко обращаются пациентки, у которых адреногенитальный синдром характеризуется поздней формой.
При пубертатной врожденной форме дефицит С21-гидроксилазы проявляется в период внутриутробного развития еще во время пубертатного периода, когда только проявляется гормональная функция коры надпочечников. Однако нарушения особенно заметны непосредственно перед наступлением у девочки первой менструации. И если обычно в популяции первая менструация протекает в 12-13 лет, то у девочек с врожденным адреногенитальным синдромом, характеризующимся пубертатной формой, первая менструация наступает значительно позже, лишь в 15-16 лет.
Менструальный цикл при данном заболевании достаточно неустойчив, менструации протекают нерегулярно, у девочек возникает тенденция к олигоменорее. Промежуток между менструациями значительный, как правило, он составляет 30-45 дней.
Гирсутизм довольно ярко выражен, довольно часто он проявляется в росте стержневых волос, расположенных по белой линии живота, в росте волос над верхней губой по мужскому принципу, на бедрах и вокруг сосков. На теле появляется большое количество сальных желез, нередко наблюдается нагноение волосяных фолликулов, кожа на лице становится жирной, поры увеличиваются и расширяются. Девушки, страдающие пубертатной формой адреногенитального синдрома, отличаются довольно высоким ростом и мужским телосложением, широкими плечами и узким тазом, наблюдается гипопластичность молочных желез. Как правило, главными жалобами таких пациенток при обращении к медикам становится возникновение угревой сыпи либо жалобы на нерегулярный менструальный цикл.
При данной постпубертатной форме заболевания симптомы адреногенитального синдрома у девушек заметны лишь после полового созревания. Довольно часто симптомы становятся ярко выраженными после медицинского аборта, во время неразвивающейся беременности либо после самопроизвольного выкидыша. Выражается в нарушении менструального цикла, промежутки между менструациями значительно увеличиваются, менструальные выделения становятся скудными, нередко возникают задержки.
В данном случае гиперандрогения характеризуется относительно мягкими признаками проявления, гирсутизм почти не выражен и проявляется лишь в незначительном оволосении на белой линии на животе, немного волос может быть на голенях, около сосков, либо над верхней губой. Молочные железы у девушки развиваются таким же образом, как у ее сверстниц, телосложение формируется по женскому типу, метаболических нарушений не проявляется.
Механизм наследования генитального синдрома
При этом заболевании наблюдаются генетические аномалии, при которых нарушается выработка гормона надпочечников – кортизола.
Существует несколько вариантов болезни, при которых страдают различные гены, отвечающие за выработку белков, необходимых для образования гормонов. В большинстве случаев «ломается» ген CYP21, кодирующий 21-гидроксилазу. На такое нарушение приходится примерно 95% случаев болезни. Однако у некоторых детей имеется сбой выработки других шести ферментов, также участвующих в процессе образования кортизола.
Риск возникновения болезни зависит от особенностей наследственности:
- Если оба родителя являются носителями болезни, но сами не болеют, вероятность рождения ребенка с генитальным синдромом составляет 25%.
- В случае если один из родителей болен, а второй является носителем, риск появления на свет больных детей составляет 75%.
- У двоих родителей, страдающих адрено-генитальным синдромом, не обязательно все дети будут больны. Часть из них не заболеет, но станет носителями пораженного гена, который передастся потомству.
- В случае, если один из родителей здоров, а второй является носителем или болен генитальным синдромом, также возможно возникновение носительства измененных генов.
Самым эффективным методом предотвращения заболевания является сдача будущими родителями анализов на генетику. Это позволит выявить вероятность развития не только этого, но и других наследственных болезней.

Подготовка к анализу на генетику
При высоком риске заболевания можно прибегнуть к репродуктивным технологиям с применением предимплантационной диагностики. В этом случае зачатие происходит «в пробирке», а эмбрион подсаживают после обследования на генетические аномалии.
Симптомы Адреногенитального синдрома:
Сольтеряющая форма дефицита 21-гидроксилазы
-
Избыток андрогенов, начиная с ранних стадий развития плода, у новорожденных девочек обуславливает интерсексуальное строение наружных гениталий (женский псевдогермафродитизм). Выраженность изменений варьирует от простой гипертрофии клитора до полной маскулинизации гениталий: пенисообразный клитор с экстензией отверстия уретры на его головку. Строение внутренних гениталий у плодов с женским генотипом при адреногенитальном синдроме всегда нормальное. У мальчиков отмечаются увеличение размеров пениса и гиперпигментация мошонки. При отсутствии лечения в постнатальном периоде происходит быстрое прогрессирование вирилизации. Быстро закрываются зоны роста костей, в результате чего у взрослых больных, как правило, отмечается низкорослость. У девочек при отсутствии лечения определяется первичная аменорея, связанная с подавлением гипофизарно-яичниковой системы избытком андрогенов.
-
Надпочечниковая недостаточность (дефицит альдостерона и кортизола) проявляется такими симптомами, как вялое сосание, рвота, обезвоживание, метаболический ацидоз, нарастающая адинамия. Развиваются характерные для надпочечниковой недостаточности электролитные изменения и дегидратация. Указанные симптомы в большинстве случаев манифестируют между 2-й и 3-й неделей после рождения ребенка. Одним из проявлений дефицита глкжокортикоидов является прогрессирующая гиперпигментация.
Простая вирильная форма дефицита 21-гидроксилазы развивается вследствие умеренного дефицита фермента, при этом сольтеряющий синдром (надпочечниковая недостаточность) не развивается. Но выраженный избыток андрогенов, начиная с внутриутробного периода, обусловливает описанные выше проявления вирилизации.
Неклассическая (постпубертатная) форма дефицита 21-гидроксилазы
Пренатальная вирилизация наружных гениталий и признаки надпочечниковой недостаточности отсутствуют. Клиническая картина значительно варьирует. Чаще всего эта форма синдрома диагностируется у женщин репродуктивного возраста при целенаправленном обследовании по поводу олигоменореи (50 % пациенток), бесплодия, гирсутизма (82 %), акне (25 %). В ряде случаев какие-либо клинические проявления и снижение фертильности практически отсутствуют.
Скрининг и другие методы диагностики
При обследовании беременных о возможности гиперплазии надпочечников может свидетельствовать аномальное формирование половых органов плода. Это можно увидеть на втором скрининговом акушерском УЗИ. В таких случаях рекомендуется дополнительное обследование для выявления патологии еще до родов. Проводят анализ амниотической жидкости или после 21 недели берут кровь плода (из пуповины под контролем УЗИ).
После родов назначается обследование:
- проба с АКТГ – нет повышения содержания кортизола после его введения;
- анализ крови – снижен натрий, повышен калий, 17 ОН-прогестерон в 5-7 раз и более, андростендион (предшественник стероидов), ренин (при сольтеряющей форме);
- анализ мочи – высокая концентрация 17-кетостероидов, после приема преднизолона снижается наполовину.
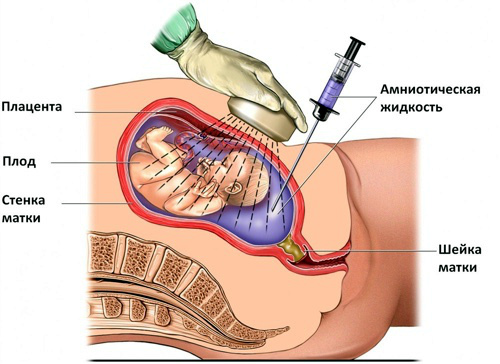 Анализ амниотической жидкости
Анализ амниотической жидкости
Для молодых женщин с нетипичным течением гиперплазии учитывают данные, полученные при:
- рентгенографии костей кисти (раннее завершение роста);
- УЗИ яичников – фолликулы, не достигающие овуляции;
- измерении температуры в прямой кишке на протяжении цикла (базальной) – отсутствие изменений, характерных для овуляции.
Лечение адреногенитального синдрома.
С целью коррекции гормональной функции надпочечников используются глюкокортикоидные препараты.
В настоящее время назначают дексаметазон в дозе 0,5-0,25 мг. в день под контролем андрогенов крови и их метаболитов в моче. Об эффективности терапии свидетельствуют нормализация менструального цикла, появление овуляторных циклов, что регистрируется измерением базальной температуры, данными эхоскопии эндометрия и яичников в середине цикла, наступлением беременности. В последнем случае терапия глюкокортикоидами продолжается во избежание прерывания беременности до 13-й недели — срока формирования плаценты, обеспечивающей необходимый уровень гормонов для нормального развития плода.
В течение первых недель беременности необходимо тщательное наблюдение: до 9 недель — измерение базальной температуры, раз в две недели — УЗИ для выявления повышенного тонуса миометрия и эхоскопических признаков отслойки плодного яйца. При самопроизвольных выкидышах в анамнезе назначают эстрогенсодержащие препараты для улучшения кровоснабжения развивающегося эмбриона: микрофоллин (этинилэстрадиол) по 0,25-0,5 мг в день или прогинова по 1-2 мг в день под контролем состояния женщины и наличия у нее жалоб на боли внизу живота, кровянистые выделения из половых путей.
В настоящее время в лечении невынашивания при адреногенитальном синдроме в I-II триместре беременности эффективно использование аналога природного прогестерона — дюфастона по 20-40-60 мг в день. Являясь производным дидрогестерона, он не обладает андрогенным эффектом в отличие от прогестагенов норстероидного ряда, что проявляется признаками вирилизации у матери и маскулинизации у плода женского пола. Кроме того, применение дюфастона эффективно в лечении функциональной истмико-цервикальной недостаточности, часто сопутствующей адреногенитальному синдрому.
В случае отсутствия беременности (овуляции или недостаточности желтого тела, регистрируемых по данным базальной температуры) рекомендуется на фоне терапии глюкокортикоидами проводить стимуляцию овуляции кломифеном по общепринятой схеме: с 5-го по 9-й или с 3-го по 7-й день цикла по 50-100 мг.
В тех случаях, когда женщина в беременности не заинтересована, а основной жалобой являются избыточное оволосение, гнойничковые высыпания на коже или нерегулярные менструации, рекомендуется терапия препаратами, содержащими эстрогены и антиандрогены (см. Лечение гирсутизма при СПКЯ). Чаще всего назначают препарат Диане-35. Более действенно в отношении гирсутизма на фоне диане назначать впервые 10-12 дней его приема ципротерон ацетат в дозе 25-50 мг (препарат андрокур). Применение этих препаратов в течение 3— 6 месяцев дает выраженный эффект.
К сожалению, по окончании приема препаратов симптомы гиперандрогении появляются вновь, поскольку причину патологии эта терапия не устраняет. Следует также отметить, что применение глюкокортикоидов, нормализующих функцию яичников, мало влияет на уменьшение гирсутизма. Антиандрогенным действием обладают оральные контрацептивы, в состав которых входят прогестины последнего поколения (дезогестрел, гестоден, норгестимат). Из негормональных препаратов эффективен верошпирон, который в дозе 100 мг в день в течение 6 месяцев и более уменьшает гирсутизм.
При поздней постпубертатной форме адреногенитального синдрома, при нерезко выраженных кожных проявлениях гиперандрогении и неустойчивом менструальном цикле без длительных задержек, пациентки, если они не заинтересованы в беременности, в гормональной терапии не нуждаются.
При применении гормональных контрацептивов предпочтение отдается низкодозированным монофазным (мерсилон) и трехфазным с гестагенным компонентом последнего поколения (дезогестрел, гестоден, норгестимат), которые не обладают андрогенным эффектом. Длительное применение однофазных гормональных контрацептивов, содержащих 30 мкг этинилэстрадиола типа марвелона или фемодена (более года без перерыва), может вызвать гиперторможение функции яичников и аменорею, обусловленную гипогонадотропными нарушениями, а не гиперандрогенией.
Диагностика адреногенитального синдрома у детей
, , , , , , , , , ,
Лабораторная диагностика адреногенитального синдрома у детей
- Всем детям с неправильным строением наружных половых органов, в том числе мальчикам с двусторонним брюшным крипторхизмом, показано определение полового хроматина и исследование кариотипа.
- С первых дней жизни в сыворотке крови больного обнаруживают повышенное содержание 17-ОН-прогестерона. Возможно проведение скрининг-теста у новорождённых на 2-5-й день жизни — 17-ОН-прогестерон повышен в несколько раз.
- При синдроме потери солей характерны гиперкалиемия, гипонатриемия, гипохлоремия.
- Повышается экскреция с мочой 17-кетостероидов (метаболиты андрогенов).
Инструментальная диагностика адреногенитального синдрома у детей
- Костный возраст по рентгенограмме лучезапястных суставов опережает паспортный.
- При УЗИ у девочек обнаруживают матку и яичники.
Дифференциальная диагностика адреногенитального синдрома у детей
У детей первого года жизни дифференциальную диагностику адреногенитального синдрома у детей проводят с различными формами ложного мужского гермафродитизма и истинным гермафродитизмом. Опорным моментом в диагностике служат кариотипирование (кариотип 46ХХ при бисексуальном строении наружных половых органов) и определение 17-ОН-прогестерона в сыворотке крови. Сольтеряющую форму врождённой дисфункции коры надпочечников следует дифференцировать с пилоростенозом, сложности возникают при дифференциальном диагнозе адреногенитального синдрома у детей и пилоростеноза у мальчиков — в этом случае имеют значение гиперкалиемия и высокий уровень 17-ОН-прогестерона при врождённой дисфункции коры надпочечников.
У детей старшего возраста при симптомах гиперандрогенемии следует помнить об андрогенпродуцирующих опухолях надпочечников или гонад.
, ,
Время чтения: мин.
Адреногенитальный синдром у детей вызывается генным нарушением, которое передается по наследству от родителей. В первую очередь это заметно по функциям надпочечников, а также по состоянию половых органов. Особенно это проявляется у женщин, так как в организме начинают преобладать мужские гормоны.
Профилактика
Мер специфической профилактики для предотвращения адреногенитального синдрома не существует. Это связано с причиной его возникновения.
Для того, чтобы предупредить рождение ребёнка с данным заболеванием следует на этапе зачатия проконсультироваться с генетиком и определить степень риска в возникновении синдрома
Это особенно важно если будущие родители или близкие родственники имеют подобную патологию
При развивающейся беременности, родителям, в семье которых встречаются случаи данной патологии следует провести кариотипирование плода, с целью проверки генотипа на наличие дефектов и соблюдать все рекомендации по ведению беременности.
Этиология и патогенез первичного гиперальдостеронизма
ГИПЕРАЛЬДОСТЕРОНЙЗМ — клинический
синдром, обусловленный высоким
содержанием в организме гормона коры
надпочечников альдостерона — стероидного
гормона, участвующего в регуляции
минерального обмена.
Альдостерон является наиболее активным
минералокортикоидом (см. Корти-костероиды).
Он стимулирует задержку в организме
ионов натрия и выведение с мочой ионов
калия и водорода. Секреция альдостерона
регулируется ренин-ангио-тензинной
системой, концентрацией в крови ионов
калия и водорода, адре-нокортикотропного
гормона, серото-нина и дофамина. В норме
содержание альдостерона в крови
составляет 2— 17 нг / 100 мл; с мочой в сутки
выводится 15—80 мкг связанного альдостерона,
0,05—0,3 мкг свободного альдостерона и
3—16 мкг так наз. кислотолабильного
альдостерона.
Гиперальдостеронизм может быть первичным
и вторичным. Первичный гипер-альдостеронизм
(синдром Конна) развивается при
повышенной секреции альдостерона,
что связано, как правило, с образованием
гормонально-активной аденомы
(альдостерономы, или альдо-стеромы) или
развитием рака коры надпочечников,
реже — с диффузной гиперплазией коры
надпочечников. При первичном
гиперальдостеронизме активность
ренина (протеолитического фермента,
участвующего в регуляции кровяного
давления вместе с биологически активным
пептидом ангиотензином) в крови снижена
или близка к норме.
Клин, картина первичного гиперальдо-стеронизма
характеризуется повторяющимися
приступами мышечной слабости,
обусловленной гипокалиемией, артериальной
гипертензией (см. Гипер-тензия
артериальная), алкалозом, поли-урией, ъ
ряде случаев приступами судорог при
нормальной концентрации кальция и
фосфора в крови.
Вторичный Гиперальдостеронизм
развивается в результате повышения
активности ренина при заболеваниях,
сопровождающихся затруднением
почечного кровотока, опухолях почек,
секретиру-ющих ренин, ограничении натрия
в рационе, бесконтрольном приеме
мочегонных и слабительных средств.
Вторичный Гиперальдостеронизм может
возникать и при тяжелых физических
нагрузках, в период так наз.
предменструального напряжения (см.
Предменструальный синдром), при
беременности и лактации, под влиянием
психического перенапряжения в
стрессовых ситуациях (см. Стресс) и др.
Клин, картина вторичного гиперальдо-стеронизма
характеризуется менее выраженными,
чем при первичном гиперальдостеронизме,
мышечной слабостью, приступами судорог
и сдвигами в водно-электролитном балансе.
Диагноз гиперальдостеронизма ставят
на основании результатов биохим.
анализов (повышенное выведение
альдостерона с мочой при нормальном
выведении 17-оксикортикостероидов,
низкое содержание в плазме крови
ионов калия, повышенное выведение
калия с мочой, алкалоз). Первичный
Гиперальдостеронизм дифференцируют с
гиперальдостерониз-мом, вызванным
реноваскулярной гипертензией, на
основании данных ангиографии почек
и определения активности ренина в
сыворотке крови.
Лечение первичного гиперальдостеронизма
заключается в хирургическом удалении
гормонально-активной опухоли надпочечников.
При вторичном гиперальдостеронизме
проводят симптоматическую терапию,
направленную на повышение выведения
натрия с мочой верош-пирон и т. п.), а
также лечение основного
Адреногенитальный синдром – симптомы
Клиническая картина описываемой генетической аномалии соответствует возрасту и форме заболевания. Адреногенитальный синдром у новорожденных иногда определить не удается, из-за чего пол младенца могут идентифицировать неправильно. Специфические признаки патологии становятся заметны с 2-4 лет, в некоторых случаях она проявляется позже, в подростковом периоде или зрелости.
Адреногенитальный синдром у мальчиков
При сольтеряющей форме болезни наблюдаются симптомы нарушения водно-солевого баланса:
- диарея;
- сильная рвота;
- пониженное артериальное давление;
- судороги;
- тахикардия;
- потеря веса.
Простой адреногенитальный синдром у детей мужского пола имеет следующие признаки:
- увеличенный пенис;
- избыточная пигментация кожи мошонки;
- темный эпидермис вокруг ануса.
Новорожденным мальчикам редко ставится указанный диагноз, потому что клиническая картина в раннем возрасте выражена слабо. Позднее (с 2-х лет) адреногенитальный синдром более заметен:
- рост волос на теле, включая половые органы;
- низкий, грубоватый голос;
- гормональные прыщи (вульгарные угри);
- маскулинизация;
- ускорение формирования костей;
- низкорослость.
Адреногенитальный синдром у девочек
Определить рассматриваемую болезнь у младенцев женского пола проще, она сопровождается такими симптомами:
- гипертрофированный клитор, внешне очень похожий на пенис;
- большие половые губы, выглядят, как мошонка;
- вагина и уретра объединены в урогенитальный синус.
На фоне представленных признаков новорожденных девочек иногда принимают за мальчиков и воспитывают в соответствии с неправильно установленным полом. Из-за этого в школьном или подростковом возрасте у таких детей часто появляются психологические проблемы. Внутри репродуктивная система девочки полностью соответствует женскому генотипу, поэтому и ощущает она себя женщиной. У ребенка начинаются внутренние противоречия и сложности с адаптацией в обществе.

После 2-х лет врожденный адреногенитальный синдром характеризуется следующими признаками:
- преждевременный рост волос на лобке и подмышками;
- короткие ноги и руки;
- мускулистость;
- появление волос на лице (к 8-ми годам);
- мужское телосложение (широкие плечи, узкий таз);
- отсутствие роста молочных желез;
- низкий рост и массивное туловище;
- грубый голос;
- угревая болезнь;
- позднее начало менструаций (не раньше 15-16 лет);
- нестабильный цикл, частые задержки месячных;
- аменорея или олигоменорея;
- бесплодие;
- скачки артериального давления;
- избыточная пигментация эпидермиса.
Лечение адреногенитального синдрома
Лабораторное и инструментальное подтверждение диагноза является обоснованием для проведения адекватной заместительной гормональной терапии с применением препаратов глюкокортикостероидного ряда.
Назначение любого глюкокортикостериода обязательно должно быть строго дозировано и подконтрольно лабораторным показателям крови и мочи. Применение Дексаметазона в суточной дозе 0,25 мг следует производить до момента устранения основных клинических проявлений заболевания (нормализация цикличности базальной температуры, устранение дисменореи, эхоскопически подтвержденное устранение мультифолликулярности яичников). Абсолютным критерием положительной эффективности гормонотерапии в этом случае является наступление запланированной беременности, однако данный факт не является показанием для прерывания приема препарата. Дексаметазон в период беременности целесообразно применять до момента формирования плаценты, которая обеспечивает нормализацию гормонального статуса плода.
Женщины, у которых период наступления беременности совпал с приемом гормональных препаратов глюкокортикоидного ряда, подлежат госпитализации в стационар с целью проведения динамического ультразвукового исследования, а также определения концентрации 17-кетостероидов в моче. Наличие у беременной женщины, принимающей гормональную терапию с целью лечения адреногенитального синдрома, самопроизвольных абортов в анамнезе является обоснованием для назначения эстроенсодержащих гормональных средств, действие которых направлено на улучшение поступления оксигенированной крови к развивающемуся плоду. Среди широкого спектра этой группы лекарственных средств наибольшее распространение получил Микрофоллин, эффективность которого максимальная в терапевтической дозе 0,25 мг в сутки. Появление у женщины кровянистых выделений или тянущих болей в нижней части живота является показанием к отмене препарата.
В связи с тем, что женщины, страдающие адреногенитальным синдромом, имеют проблемы с вынашиванием плода и склонность к возникновению самопроизвольного выкидыша на раннем сроке беременности, целесообразным в данной ситуации является назначение природного аналога прогестерона «Дюфастона» в суточной дозе 20 мг. Длительный прием данного препарата устраняет истмикоцервикальную недостаточность, которая является самой распространенной причиной самопроизвольного аборта.
Препаратом, оказывающим стимулирующее влияние на процесс развития овуляции, является Кломифен, применение которого рекомендуется сочетать с глюкокортикоидной терапией. Пациенткам обязательно необходимо соблюдать режим приема препарата, заключающийся в приеме его в суточной дозе 100 мг с третьего по седьмой день менструального цикла каждый месяц до наступления беременности.
В ситуации, когда признаки адреногенитального синдрома дебютировали в зрелом возрасте, когда женщина не заинтересована в сохранении репродуктивной функции, рекомендуется терапия заболевания с применением комбинированных препаратов, содержащих антиандрогены и эстрогены (Андрокур в дозировке 25 мг). Следует учитывать, что данную группу препаратов относят к категории симптоматических, устраняющих незначительные фенотипические проявления заболевания, и при отмене приема препарата возможно обратное развитие болезни.
Для борьбы с гипергисутизмом гормональная терапия не применяется и в данной ситуации эндокринологи прибегают к назначению Верошпирона в суточной дозе 100 мг утром, длительный прием которого значительно уменьшает проявления избыточного оволосения.
Областью применения гормональных препаратов контрацепции, содержащих низкодозированный гестагенный компонент, лишенный андрогенного влияния, является группа пациенток с признаками поздней постпубертатной формы адреногенитального синдрома. Прежде чем применять данную группу препаратов, следует удостовериться в нежелании пациентки сохранять репродуктивную функцию, так как данные гормональные средства при длительном приеме провоцируют развитие аменореи гипогонадотропного типа.
Другие заболевания из группы Болезни мочеполовой системы:
| «Острый живот» в гинекологии |
| Альгодисменорея (дисменорея) |
| Альгодисменорея вторичная |
| Аменорея |
| Аменорея гипофизарного генеза |
| Амилоидоз почек |
| Апоплексия яичника |
| Бактериальный вагиноз |
| Бесплодие |
| Вагинальный кандидоз |
| Внематочная беременность |
| Внутриматочная перегородка |
| Внутриматочные синехии (сращения) |
| Воспалительные заболевания половых органов у женщин |
| Вторичный амилоидоз почек |
| Вторичный острый пиелонефрит |
| Генитальные свищи |
| Генитальный герпес |
| Генитальный туберкулез |
| Гепаторенальный синдром |
| Герминогенные опухоли |
| Гиперпластические процессы эндометрия |
| Гонорея |
| Диабетический гломерулосклероз |
| Дисфункциональные маточные кровотечения |
| Дисфункциональные маточные кровотечения перименопаузального периода |
| Заболевания шейки матки |
| Задержка полового развития у девочек |
| Инородные тела в матке |
| Интерстициальный нефрит |
| Кандидоз влагалища |
| Киста желтого тела |
| Кишечно-генитальные свищи воспалительного генеза |
| Кольпит |
| Миеломная нефропатия |
| Миома матки |
| Мочеполовые свищи |
| Нарушения полового развития девочек |
| Наследственные нефропатии |
| Недержание мочи у женщин |
| Некроз миоматозного узла |
| Неправильные положения половых органов |
| Нефрокальциноз |
| Нефропатия беременных |
| Нефротический синдром |
| Нефротический синдром первичный и вторичный |
| Обостренные урологические заболевания |
| Олигурия и анурия |
| Опухолевидные образования придатков матки |
| Опухоли и опухолевидные образования яичников |
| Опухоли стромы полового тяжа (гормонально-активные) |
| Опущение и выпадение (пролапс) матки и влагалища |
| Острая почечная недостаточность |
| Острый гломерулонефрит |
| Острый гломерулонефрит (ОГН) |
| Острый диффузный гломерулонефрит |
| Острый нефритический синдром |
| Острый пиелонефрит |
| Острый пиелонефрит |
| Отсутствие полового развития у девочек |
| Очаговый нефрит |
| Параовариальные кисты |
| Перекрут ножки опухолей придатков матки |
| Перекрут яичка |
| Пиелонефрит |
| Пиелонефрит |
| подострый гломерунефрит |
| Подострый диффузный гломерулокефрит |
| Подслизистая (субмукозная) миома матки |
| Поликистоз почек |
| Поражение почек при миеломной болезни |
| Поражение почек при подагре |
| Пороки развития половых органов |
| Постгистерэктомический синдром |
| Постменопауза |
| Почечнокаменная болезнь |
| Предменструальный синдром |
| Прямокишечно-влагалищные свищи травматического генеза |
| Психогенная аменорея |
| Радиационные нефропатии |
| Рак шейки матки |
| Рак эндометрия |
| Рак яичников |
| Реноваскулярная гипертензия |
| Саркома матки |
| Сертоли |
| Синдром истощения яичников |
| Синдром поликистозных яичников |
| Синдром после тотальной овариэктомии |
| Синдром приобретенного иммунодефицита (СПИД) у женщин |
| Синдром резистентных яичников |
| Тератобластома |
| Тератома |
| Травмы половых органов у девочек |
| Трихомониаз |
| Туберкулез мочеполовых органов |
| Урогенитальные инфекции у девочек |
| Урогенитальный хламидиоз |
| Феохромоцитома |
| Хроническая почечная недостаточность |
| Хронический гломерулонефрит |
| Хронический гломерулонефрит (ХГН) |
| Хронический диффузный гломерулонефрит |
| Хронический интерстициальный нефрит |
| Хронический пиелонефрит |
| Хронический пиелонефрит |
| Эндометриоз (эндометриоидная болезнь) |
| Ювенильные маточные кровотечения |