Что означает резистентность к антибиотикам, и можно ли это исправить
Содержание:
- Резистентность к антибиотикам
- Что такое устойчивость к антибиотикам?
- Сдерживание распространения антибиотикорезистентности
- Классификация антибиотиков
- Как бактерии приобретают устойчивость?
- Проблема антибиотикорезистентности
- Правила приема антибиотиков
- Причины антибиотикорезистентности
- Нобелевка из козявок и мочи
- Резистентность к антибиотикам
- Показания и исследуемые пробы
- Гены антибиотикорезистентности
- Самые «проблемные» возбудители
Резистентность к антибиотикам
К основным факторам, приводящим к развитию резистентности к антибиотикам, относят:
- питьевая вода низкого качества;
- антисанитарные условия;
- бесконтрольное применение антибиотиков, а также их использование на животноводческих фермах для лечения животных и роста молодняка.
Среди основных подходов к решению проблем по борьбе с инфекциями при резистентности к антибиотикам ученые приходят к:
- Разработке новых видов антибиотиков.
- Изменение и модификация химических структур.
- Новые разработки препаратов, которые будут направлены на клеточные функции.
- Ингибирование вирулентных детерминант.
Что такое устойчивость к антибиотикам?
Представьте себе ситуацию, когда программист борется с хакером. Чем более совершенную антивирусную программу создаст ИТ-специалист, тем более сложные вирусы будет создавать хакер. После каждого нового вируса, который проник в систему и не был обнаружен и удален существующей антивирусной программой, ИТ-специалист должен подготовить улучшенный алгоритм. Когда на рынке появляется последняя антивирусная программа, хакеры уже начинают работать над другим вирусом, устойчивым к этой программе.
Устойчивость к антибиотикам – аналогичное явление, только оно возникает, когда бактерии приобретают устойчивость. Чем лучше и эффективнее антибиотик представлен на рынке, тем больше бактерий сосредоточено на изменении своих свойств, нейтрализующих свойства нового препарата. Так возникает устойчивость к антибиотикам.
С этой целью бактерии могут изменять свой генетический материал таким образом, что устойчивость к новому антибиотику становится их постоянной характеристикой, передаваемой будущим поколениям. Если с последующей серией лекарств, созданных учеными, бактерии приобретают устойчивость к воздействиям, то мутации в бактериальной ДНК накапливаются и образуют бактериальные штаммы, устойчивые практически к большинству антибиотиков. Этот процесс является основой бактериальной устойчивости к антибиотикам.

Устойчивость к антибиотикам
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
Системные антибиотики в России, как и в большинстве развитых стран мира, относятся к лекарственным препаратам рецептурного отпуска, однако это требование далеко не всегда соблюдается. Недавнее исследование в рамках проводимой информационной кампании “Антибиотик надежное оружие, если цель бактериальная инфекция” показало, что 57% провизоров и фармацевтов аптечных учреждений Смоленска согласились продать антибиотик пациенту с симптомами острой респираторной инфекции без назначения врача. Более 60% опрошенных жителей Смоленска сообщили, что принимают антибиотики без назначения врача; у 38% опрошенных есть антибиотики в домашней аптечке. Таким образом, возможность свободного доступа стимулирует широкое использование антибиотиков населением для самолечения, что означает высокую вероятность их избыточного применения, ошибок при выборе препарата, дозы, длительности лечения.
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Одним из перспективных направлений в борьбе с инфекциями является применение бактериофагов и их компонентов. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов позволят справиться с устойчивыми к АМП микроорганизмами, однако эти препараты появятся не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для лечения инфекций, вызванных C. difficile, S. aureus, P. aeruginosa .
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы мер по противодействию устойчивости микроорганизмов к АМП. Это подразумевает усиление мониторинга лекарственноустойчивых инфекций и контроля за применением АМП в медицине, ветеринарии и сельском хозяйстве, а также укрепление международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения АМП, заниматься поиском рационального их использования (улучшение диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (вакцинация, очистка воды, санитария, должный уровень гигиены в стационарах и на фермах) .
Классификация антибиотиков
Антибиотики – это группа антибактериальных препаратов, предназначенных для уничтожения или остановки размножения бактерий. Изначально антибиотики получали только естественным путем, сегодня существует огромное количество бактериостатиков, синтезированных в лабораториях (химиотерапевтические препараты). Из-за частой аллергии на пенициллин и устойчивости многочисленных бактериальных штаммов к его воздействию были разработаны различные группы антибиотиков без пенициллина.

Классификация антибиотиков
Есть несколько категорий, по которым можно классифицировать антибиотики. Первая делит их на натуральные и синтетические. Основным критерием разделения является химическая структура антибиотиков, основанная на их механизме действия против бактерий.
Существуют:
- бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобактамы);
- пептидные антибиотики;
- аминогликозиды;
- тетрациклин;
- макролиды.
Макролиды, тетрациклины, карбапенемы, цефалоспорины 3-го, 4-го и 5-го поколений и некоторые пенициллины обладают очень широким спектром действия. Они борются с так называемыми грамположительными и грамотрицательными бактериями, а также нетипичными микроорганизмами.
Разделение бактерий в соответствии с методом Грама основано на структуре бактериальной клеточной стенки и результирующем цвете, в который бактериальная клетка окрашивает при просмотре под микроскопом.
Цефалоспорины второго поколения, монобактамы и аминогликозиды ингибируют (подавляют) пролиферацию главным образом грамотрицательных бактерий, а цефалоспорины первого поколения предотвращают синтез грамположительных клеток.
Как бактерии приобретают устойчивость?
Антибиотики помогают при лечении инфекций, пока на бактерии есть «мишени» для действия препарата. «Мишенью» может быть компонент клеточной стенки или какой-либо фермент, участвующий во внутриклеточных процессах бактерии. Эффективность антибактериального лечения снижается по нескольким причинам.
Мутация
На клеточной стенке возбудителей существуют так называемые пенициллинсвязывающие белки. Они участвуют в процессе образования клеточной стенки микробов. Именно эти белки являются «мишенью» для действия антибиотика.
В процессе эволюции бактерии мутируют, а структура белка изменяется. Чем сильнее отличается новый белок от старого, тем менее эффективно антибактериальное лечение.
Бактерии научились удалять препарат
Даже проникнув внутрь клетки, антибиотик может не подействовать. В бактериях есть транспортные белки, которые выводят все препараты из клетки, как наш организм, например, удаляет вредные вещества через почки. Это явление у микробов называется эффлюксом или активным выведением.
Бактерии перешли в атаку
Чтобы высокие дозы антибиотика не могли разрушить и даже замедлить рост бактерий, последние стали выделять токсины в ответ. Например, чтобы пенициллин не нарушал процесс сборки бактериальной стенки, микробы продуцируют бета-лактамазу. Этот фермент связывается с пенициллином и инактивирует его.
Микробы установили «фейсконтроль»
Многие антибиотики действуют не на клеточную стенку бактерий, а на ее внутренние процессы. Чтобы проявить свой противомикробный эффект, молекула препарата должна проникнуть через мембрану возбудителя. Обычно антибиотики проникают прямо через стенку микроба. Но существует особая группа бактерий, у которых есть дополнительный защитный слой в стенке – липополисахаридные «трубочки». Антибиотик не может преодолеть этот слой, поэтому направляется к порам, через которые в клетку бактерии попадают питательные вещества и выделяются продукты ее жизнедеятельности. Многие микробы научились суживать эти коридоры, чтобы крупные молекулы антибиотика не могли пройти внутрь.
Бактерии нашли другой способ питания
Некоторые антибактериальные средства «притворяются» химическим соединением, которое необходимо микробам для обмена веществ. Проникая внутрь клетки под видом «стройматериала», антибиотик встраивается в ее метаболизм. Но из-за «диверсанта» бактерии собирают свои белки неправильно, что приводит к гибели возбудителей. Если микроб находит новый источник питания, он перестает реагировать на антибиотик, который был похож на его «еду».
Обмен опытом
Способность не поддаваться действию антибиотиков сохраняется в геноме бактерии в виде гена резистентности или r-гена. R-ген передается всем потомкам выжившей бактерии после ее деления. Но оказалось, что информацию о том, как победить лекарство, бактерия передает не только дочерним клеткам, но и своим «соседям». Между двумя микробами образуется «мостик», через который переходит плазмид – переносчик фрагмента ДНК бактерии. Благодаря такой взаимной поддержке микробов мы можем столкнуться с проблемой тотальной устойчивости.
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России .
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Многими экспертами не раз уже отмечено, что хотя генерические препараты являются важным инструментом снижения общих затрат здравоохранения, по целому ряду из них отсутствуют адекватные исследования эффективности и безопасности по сравнению с оригинальными препаратами. Несколько исследований, проведенных в Российской Федерации, продемонстрировали наличие более низких концентраций активных субстанций в ряде “псевдогенериков”, что потенциально может приводить не только к снижению эффективности терапииу конкретного пациента, но и более быстрому росту резистентности к целому классу антибиотиков. В настоящее время рассматривается возможность внесения поправок к Федеральному закону №61. Согласно предложенным поправкам для регистрации новых генериков необходимо будет проводить исследование биоэквивалентности регистрируемого генерика по сравнению с оригинальным препаратом, а не любым уже зарегистрированным генериком.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ
Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) .
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
Правила приема антибиотиков

Джуди Сметзер, вице-президент американского Института безопасной практики медикаментозного лечения, говорит о пяти основных правилах приема лекарств, которые следует учитывать также и при приеме антибиотиков: правильный пациент должен получать правильное лекарство в правильное время в правильной дозе и правильным способом применения.
Какие еще правила следует соблюдать при лечении антибиотиками?
Самое важное правило — проводить лечение до конца и не уменьшать назначенные врачом дозировки. По данным российских исследований, каждая четвертая мама не доводит курс антибиотиков, прописанных ее ребенку, до конца
В то же время затягивать прием на более длительный срок тоже нельзя — это дает дополнительный шанс инфекции найти способ борьбы с препаратом. Только «золотая середина» способна эффективно остановить инфекцию.
Антибиотики узкого спектра, то есть действующие на ограниченное число бактерий, безопаснее и предпочтительнее препаратов широкого спектра
Чем точнее воздействие, тем меньше шансов на выживание патогенных бактерий.
В идеале перед назначением антибиотиков следует пройти обследование на чувствительность к тем препаратам, которые будут назначены.
Особое внимание при лечении антибиотиками в больницах следует уделить риску заражения внутрибольничными инфекциями. Это значит, что санитарная обработка и дезинфекция должны проводиться на максимально доступном уровне.
-
Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск, 2007.
-
US woman dies of infection resistant to all 26 available antibiotics // MedicalXpress. 13.01.2017. -
Scientists examine bacterium found 1,000 feet underground // Еurekalert.org/ 8.12.2016. -
MRSA-killing antibiotic produced by bacteria in the nose // UPI. 27.07.2016. -
Researchers may have found second ‘superbug’ gene in U.S. patient // Reuters. 27.06.2016.
Причины антибиотикорезистентности
Тут мы подошли к главному вопросу, кто же виноват, что бактерии при воздействии на них антибактериальных средств не умирают, а прямо-таки перерождаются, приобретая новые свойства, которые далеко не на руку человечеству? Что провоцирует такие изменения, происходящие с микроорганизмами, являющимися причиной многих болезней, с которыми человечество борется не одно десятилетие?
Понятно, что истинной причиной развития антибиотикорезистентности является способность живых организмов выживать в различных условиях, приспосабливаясь к ним разными путями. Но ведь возможности увернуться от смертельного снаряда в лице антибиотика, который по идее должен нести им смерть, у бактерий нет. Так как же получается, что они не только выживают, но и усовершенствуются параллельно с усовершенствованием фармацевтических технологий?
Нужно понимать, что если есть проблема (в нашем случае развитие антибиотикорезистентности у патогенных микроорганизмов), значит есть и провоцирующие факторы, создающие для нее условия. Как раз в этом вопросе мы сейчас и попробуем разобраться.
Нобелевка из козявок и мочи
В начале 1870-х Вячеслав Манассеин и Алексей Полотебнов первыми открыли, что зеленая плесень пеницилл борется с кожными заболеваниями. В 1922 году британец Александр Флеминг посеял в чашку Петри свои сопли. Оказалось, что находящийся в них фермент лизоцим убил бактерии. В 1928-м он выделил из грибов пенициллин. Весной 1941 года первым пациентом стал Альберт Александер, констебль из Оксфорда.
Зинаида Ермольева открыла «советский пенициллин» (1942). Но помнит весь мир британца Флеминга. Фото: Legion-media.ru и РИА «Новости»
Лекарства было мало, пришлось фильтровать мочу полицейского, чтобы использовать пенициллин повторно. Пациент поправлялся, однако препарата было мало, и он умер. В 1943 году выпустили 21 млрд доз для фронта. За открытие Флеминг получил Нобелевскую премию и рыцарский титул. Одновременно с Флемингом в СССР пенициллин открыла Зинаида Ермольева. В осажденном Сталинграде она наладила выпуск 50 тыс. доз ежедневно, чем спасла сотни тысяч жизней. Была удостоена звания профессора, Сталинской премии и ордена Ленина дважды.
Резистентность к антибиотикам
Самый интересный пример резистентности можно рассмотреть на примере способностей бактерий, отличающихся удивительной способностью к выживанию.
Еще 15 лет назад в Дании на научной конференции, посвященной проблеме антибиотикорезистентности, сама глава ВОЗ М.Чен, отбросив всякую дипломатию, заявила о наступлении новой эры, высказав опасения, что той медицине, которую мы знаем сегодня, наступает конец.
Спустя максимум два, три десятилетия, если не принять экстренные меры, человечество начнет умирать от инфекций при обычной царапине, не говоря уже о серьезных заболеваниях.
Еще относительно недавно, изобретение пенициллина дало надежду на полную победу над бактериальными инфекциями. Но не тут-то было. Прошли годы, но изобретения ни 1-го, ни 2-го, ни 3-го, ни даже 4-го поколения антибактериальных препаратов не дало желаемых результатов.
Мутация бактерий происходит с такой скоростью, что опережает изобретение новых препаратов.
Бактерии не живут поодиночке, они обитают популяциями. В своих «сообществах» научились общаться между собой и как настоящие воины выстраивать защиту и тактику нападения.
Многие из них обладают природной резистентностью, иные – приобрели устойчивость в результате мутации, используя разные механизмы для выживаемости:
- синтезируя ферменты (что это?), разрушающие активный компонент антибиотиков или модифицируя их молекулы;
- изменяя РНК-синтетаз и рибосом, проницаемость своих клеточных стенок или полностью всю клеточную структуру;
- нарушая процессы транспорта антибиотика к бактериальным клеткам.
К тому же одна и та же бактерия способна использовать для выживания несколько эффективных механизмов. С каждым годом появляются все новые и новые неизвестные популяции.
В США обнаружена популяция различных штаммов, так называемых кошмарных бактерий (CRE), устойчивых даже к самым новейшим классам антибиотиков. Бессимптомное инфицирование не дает возможность проследить их распространение. За прошедший год инфицировано до 10 000 человек, 600 из которых погибло.
В Индии от неизвестной бактерии, резистентной ко всем известным видам антибиотиков, погибло более 5 000 человек. В это время ученые из США изобрели препарат «Тиенам», способный, согласно всем своим параметрам, справиться с самыми опасными микроорганизмами. Кстати, не из дешевых – 600 долларов за дозу.
Каково же было удивление, когда, наблюдая в микроскоп за поведением микроорганизма, изобретатели увидели, как один конец бактерии с аппетитом поедает препарат, а другой, выплевывает его остатки. Как говорится – 600 долларов бактерии под хвост.
Во время раскопок в пещере Лечугилье (США) на глубине 300 метров ученые обнаружили бактерии, возраст которых – 4 000 000 лет. Анализ на резистентность показал, что они устойчивы по отношению к 18 современных антибиотиков, включая последние разработки.
Это говорит о том, что эволюция позаботилась о механизме их резистентности задолго до появления потенциальной опасности, в виде антибиотиков.
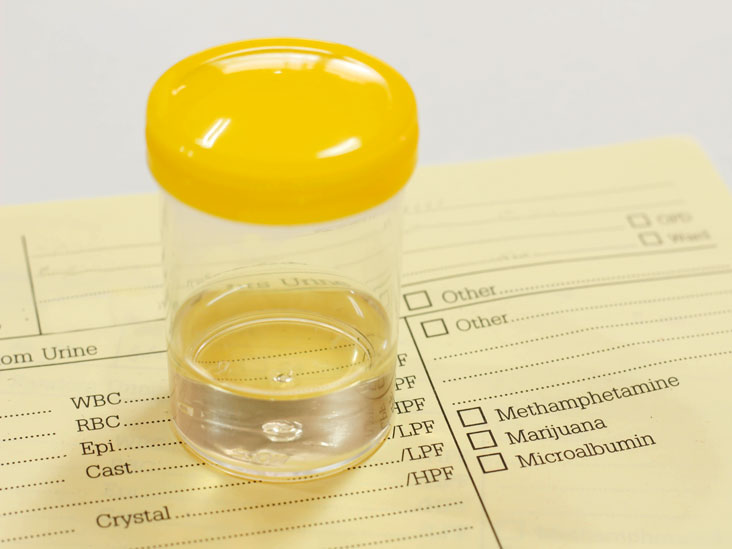
Показания и исследуемые пробы
Основными показаниями к назначению анализа являются острые воспалительные процессы бактериальной природы и составление плана дальнейшего ведения пациента. Анализ применяется в хирургии, урологии, нефрологии, онкологии других отраслях медицины.
Исследуемый биологический материал зависит от текущего клинического анамнеза пациента, локализации воспалительного очага. При обширном сепсисе рекомендуется развернутое изучение всех биологических материалов. Для исследования подходят:
- Кровь. Биохимический развернутый гемотест помогает определить не только тип возбудителя, но и общее состояние организма в целом.
- Урина. Бакпосев мочи проводится для уточнения половых инфекций, воспаления почек, органов урогенитальных путей.
- Анализ кала. Применяется в отношении пациентов с воспалением кишечного тракта, осложнениями острых кишечных инфекций, подозрением на паразитарные инфекции. Одновременно изучают физические и химические параметры каловых масс.
- Мазок из цервикального канала у женщин. Метод исследования помогает определить инфекции половых путей.
- Исследование спермы, мазок из уретры, секрет простаты. Анализы на бактериальный посев применяются для уточнения инфекций различной локализации у мужчин.
- Анализ мокроты. Помогает в диагностике дыхательных заболеваний, туберкулеза легких, пневмонии. Одновременно оценивают количество примесей — гноя, крови, слизи.
При хронических патологиях респираторного тракта и дыхательной системы возможно проведение забора мазка из носовых ходов, гортани. Анализ широко распространен в педиатрии ввиду легкости забора биологического материала.
Гены антибиотикорезистентности
Существуют понятия генетической и негенетической лекарственной резистентности. С последней мы имеем дело, когда рассматриваем бактерии с неактивным метаболизмом, не склонные к размножению в обычных условиях. У таких бактерий может вырабатываться антибиотикорезистентность к определенным видам препаратов, тем не менее, их потомству эта способность не передается, поскольку она не заложена генетически.
Это свойственно патогенным микроорганизмам, вызывающим туберкулез. Человек может заразиться и не подозревать о болезни долгие годы, пока его иммунитет в силу каких-то причин не даст сбой. Этой является толчком к размножению микобактерий и прогрессированию болезни. Но для лечения туберкулеза используются все те же препараты, вед бактериальное потомство по-прежнему остается чувствительным к ним.
Точно так же обстоит дело и с утратой белка в составе клеточной стенки микроорганизмов. Вспомним, опять же о бактериях, чувствительных к пенициллину. Пенициллины тормозят синтез белка, служащего для построения клеточной оболочки. Под воздействием АМП пенициллинового ряда микроорганизмы могут утрачивать стенку клеток, строительным материалом которой является пенициллинсвязывающий белок. Такие бактерии становятся резистентными к пенициллинам и цефалоспоринам, которым теперь не с чем связываться. Это явление временное, не связанное с мутацией генов и передачей видоизмененного гена по наследству. С появлением клеточной стенки, свойственной предыдущим популяциям, антибиотикорезистентность у таких бактерий исчезает.
О генетической антибиотикорезистентности говорят, когда изменения в клетках и метаболизме внутри них происходят на уровне генов. Мутации генов могут вызывать изменения в структуре клеточной мембраны, провоцировать выработку ферментов, защищающих бактерии от антибиотиков, а также изменять количество и свойства рецепторов бактериальной клетки.
Здесь существует 2 пути развития событий: хромосомный и внехромосомный. Если происходит мутация гена на том участке хромосомы, который отвечает за чувствительность к антибиотикам, говорят о хромосомной антибиотикорезистентности. Сама по себе такая мутация возникает крайне редко, обычно ее вызывает действие лекарств, но опять-таки не всегда. Контролировать это процесс очень сложно.
Хромосомные мутации могут передаваться из поколения в поколение, постепенно формируя определенные штаммы (разновидности) бактерий, устойчивых к тому или иному антибиотику.
Виновниками внехромосомной резистентности к антибиотикам становятся генетические элементы, существующие вне хромосом и называемые плазмидами. Именно эти элементы содержат гены, ответственные за выработку ферментов и проницаемость бактериальной стенки.
Антибиотикорезистентность чаще всего является результатом горизонтального переноса генов, когда одни бактерии передают некоторые гены другим, не являющимся их потомками. Но иногда можно наблюдать и несвязанные точечные мутации в геноме патогена (размер 1 в 108 за один процесс копирования ДНК материнской клетки, что наблюдается при репликации хромосом).
Так осенью 2015 года ученые из Китая описали ген MCR-1, обнаруженный в свином мясе и кишечнике свиней. Особенностью этого гена является возможность его передачи другим организмам. Спустя некоторое время этот же ген был найден не только в Китае, но и в других странах (США, Англия, Малайзия, страны Европы).
Гены антибиотикорезистентности способны стимулировать выработку ферментов, которые ранее не вырабатывались в организме бактерий. Например, фермент NDM-1(металло-бета-лактамаза 1), обнаруженный у бактерий Klebsiella pneumoniae в 2008 году. Сначала он был обнаружен у бактерий родом из Индии. Но в последующие годы фермент, обеспечивающий антибиотикорезистентность относительно большинства АМП, был выявлен у микроорганизмов и в других странах (Великобритания, Пакистан, США, Япония, Канада).
Патогенные микроорганизмы могут проявлять устойчивость как по отношению к определенным препаратам или группам антибиотиков, так и относительно различных групп препаратов. Существует такое понятие, как перекрестная антибиотикорезистентность, когда микроорганизмы становятся нечувствительными к препаратам со сходным химическим строением или механизмом воздействия на бактерии.
Самые «проблемные» возбудители
В 2017 году Всемирная Организация Здравоохранения опубликовала список из 12 возбудителей, с которыми врачам труднее всего справляться с помощью имеющихся антибиотиков. Критичную устойчивость проявляют некоторые возбудители внутрибольничных инфекций, особенно псевдомонады. Они научились разрушать даже антибиотики широкого спектра действия. Все чаще противомикробные препараты оказываются неэффективными при лечении гонореи, сальмонеллеза и язвы двенадцатиперстной кишки, вызванной жгутиковой бактерией хеликобактер. Серьезную угрозу представляет золотистый стафилококк, который часто попадает в кровь и поражает сердечные клапаны. Среднюю устойчивость приобрели некоторые возбудители инфекций дыхательных путей и пневмонии – клебсиелла, пневмококк и гемофильная палочка.
Устойчивость бактерий может быть нескольких видов:
- монорезистентность – если микроб устойчив только к одному классу антибиотиков;
- мультирезистентность – когда три и более класса антибактериальных средств не могут уничтожить возбудителя;
- чрезвычайно высокая нечувствительность – устанавливается, если бактерия устойчива практически ко всем группам антибиотиков, за исключением одного — двух лекарственных препаратов;
- тотальная резистентность – невосприимчивость ко всем известным антибиотикам.
Антибиотик может действовать на 90% «старых» штаммов, но оказаться бессильным, встретив новую группу возбудителей. Именно поэтому врачи перед назначением лекарства проводят тест на чувствительность патогена к антибиотику. Чтобы узнать, подействует ли препарат, проводят лабораторный анализ. У больного берут кровь, мочу, кал, мокроту или воспалительную жидкость из тканей. Материал наносят на питательную среду, в которой уже есть антибиотики. Если на одном из участков бактерии растут, значит, лекарство неэффективно.