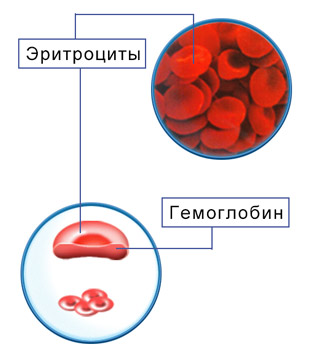
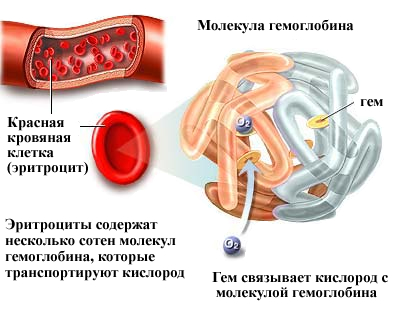
Строение гемоглобина и миоглобина
Содержание:
- Роль железа в синтезе гемоглобина
- Диагностика уровня гемоглобина
- Физиология[править | править код]
- Что такое уровень гемоглобина в крови?
- Полезные свойства эмбрионального гемоглобина
- Разница между гемоглобином и миоглобином
- Нормы свободного гемоглобина для детей
- Как диагностируют патологические формы железосодержащего белка в крови?
- Строение гемоглобина
- Способы предотвращения окисления железа гемоглобина
- Строение[править | править код]
- Уровень свободного гемоглобина у взрослых
- Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
Роль железа в синтезе гемоглобина
Железо является необходимым компонентом для синтеза гемоглобина, так как оно обеспечивает связи ядер порфирина, аминокислот глобина, то есть оно удерживает весь комплекс. Биологическая роль железа состоит также в:
- связывании кислорода в легких;
- транспортировке кислорода к тканям и внутриклеточном переносе к митохондриям;
- использовании кислородных ионов для образования энергии;
- обезвреживании токсичных соединений.
Источниками минерала является пища и ионы, образовавшиеся при распаде гемоглобина (повторное использование). Усиление всасывания железа из кишечника происходит при снижении его запасов. Хранится микроэлемент в виде ферритина.
Диагностика уровня гемоглобина
Исследование уровня гемоглобина: назначение, подготовка и процедура
Гемоглобин входит в клинический анализ крови. Поэтому чаще всего назначается полный анализ крови и оцениваются все показатели в целом, даже если важен лишь гемоглобин.
При подозрении на сахарный диабет сдают отдельный анализ на гликированный гемоглобин. При этом у пациента наблюдается повышенная жажда, частое мочеиспускание, он быстро устает и часто болеет вирусными заболеваниями.
В любом случае кровь сдается утром на голодный желудок. Желательно, чтобы после последнего приема пищи прошло не менее 8 часов. Накануне анализа нежелательно заниматься физическими нагрузками, курить, употреблять алкоголь и любые лекарственные препараты. Если некоторые препараты отменить невозможно, об их приеме необходимо сообщить лечащему врачу. Придерживаться диеты не обязательно, но рекомендуется воздержаться от жирной и жареной пищи, поскольку показатели могут измениться. Во время беременности анализ на гемоглобин (и другие показатели в целом) сдается часто, раз в несколько недель, при необходимости каждую неделю.
В различных лабораториях исследование крови на гемоглобин проводится по-разному в зависимости от имеющихся приборов. Измеряется либо содержание железа в гемоглобине, либо оценивается насыщенность цвета раствора крови.
Полезное видео — Гликированный гемоглобин повышен.
Читайте: Анализ крови на АЛТ — норма и отклонение фермента
Чаще всего для измерения уровня гемоглобина используют соляную кислоту. Этот метод называется метод Сали. Полученный материал в определенном количестве смешивают с кислотой, а затем доводят до стандартного цвета с помощью дистиллированной воды. Количество гемоглобина определяется путем соотношения полученного объема с принятыми стандартами. Метод Сали используется давно, он несколько длительный и субъективный, во многом зависит от человеческого фактора. Однако современная медицина позволяет определять уровень гемоглобина более точными и автоматизированными методами, с помощью прибора под названием гемометр. Этот метод более быстрый, но тоже может давать расхождения до 3 грамм на литр.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин, специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).
Что такое уровень гемоглобина в крови?
Для человека уровень железосодержащего белка показатель здоровья организма. Отклонение от нормы легко вычислить с помощью общего анализа крови. Своевременно проведенный анализ не дает возможности точно установить диагноз, но поможет описать общую картину физического состояния человека и составить первоначальные диагностические выводы. Если данного метода недостаточно, назначается биохимия крови, позволяющая получить детальную информацию.
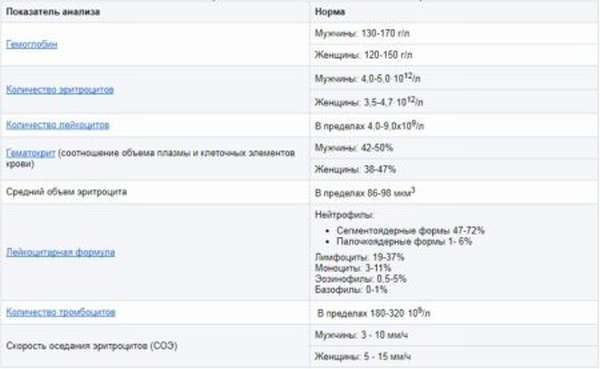
Норма железосодержащего белка для мужчин, женщин и детей различается. Для определения отклонений показателя учитывается пол пациента и возраст.
В разных лабораториях используют любую из систем измерения, поэтому выводы на основании результатов анализа не следует делать самостоятельно. Лучше обратиться за помощью к врачу.
В крови у новорожденных детей обнаружен наиболее высокий предел уровня гемоглобина и иная структура, что не является патологией для младенцев. В процессе взросления показатель падает и приближается к показателю взрослого здорового человека. Изменяется строение железосодержащего белка.
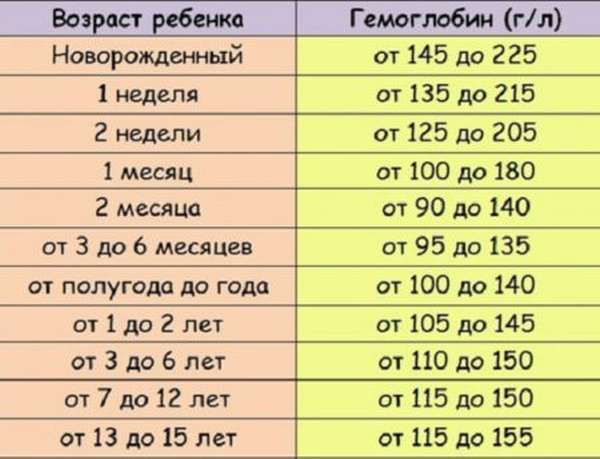
Норма гемоглобина у детей до 12 лет не связана с половой принадлежностью. Различие в показателях появляется с наступлением полового созревания. По сравнению с мужскими показателями уровень железосодержащего белка у женщин ниже на 10%. Узнать нужный показатель можно с помощью приведенной ниже таблицы.
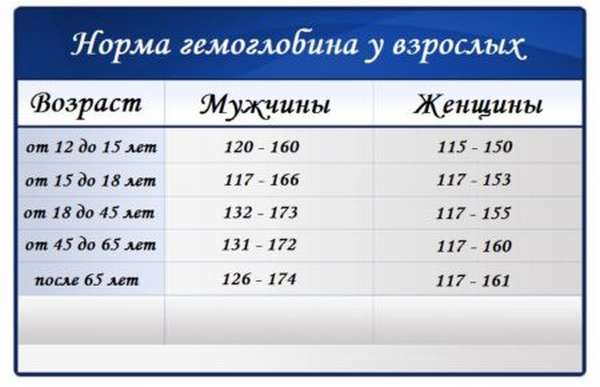
У женщин в силу естественных причин возможны отклонения от нормальных показателей. Например: во время вынашивания ребенка уровень гемоглобина находится ниже общепринятой нормы. На начальных этапах беременности это происходит из-за увеличения объема плазмы в крови будущей мамы. Такое состояние не критическое, и постепенно концентрация гемоглобина придет в норму.
Во втором триместре беременности следует тщательно наблюдать за гемоглобиновым показателем, так как у плода в процессе внутриутробного развития появляется необходимость в железе, которое он получает от организма матери. Данная ситуация представляет опасность, ведь появляется риск анемии у матери, в результате чего мозг плода испытывает недостаток кислорода. Во избежание последствий важен постоянный контроль над содержанием гемоглобина в крови женщины.
Чаще всего понижение железосодержащего белка в крови беременной женщины временное явление и не требует врачебного вмешательства. Однако при длительном и значительном отклонении показателя от нормы необходима консультация специалиста. Обращение к врачу понадобится при следующей симптоматике:
- головные боли и головокружения,
- общая слабость и снижение работоспособности,
- нарушения сна,
- снижение иммунных сил организма,
- сухость кожных покровов и ломкость ногтевой пластины и волос.
Уменьшение гемоглобина ухудшает обменные процессы в организме. Подобное состояние негативно сказывается на здоровье будущей мамы и ребенка.
Полезные свойства эмбрионального гемоглобина
Анализы на гемоглобин f помогают выявить патологии на ранних стадиях развития. Исследования назначают:
- чтобы проверить, насколько физиологическое развитие недоношенного новорожденного отличается от нормы;
- для обнаружения лейкоза на ранней стадии;
- при подтверждении или опровержении диагноза гемолитическая анемия у младенцев возраста до 5 месяцев;
- для предупреждения апноэ;
- для того чтобы выявить предрасположенность к развитию гипоксии.
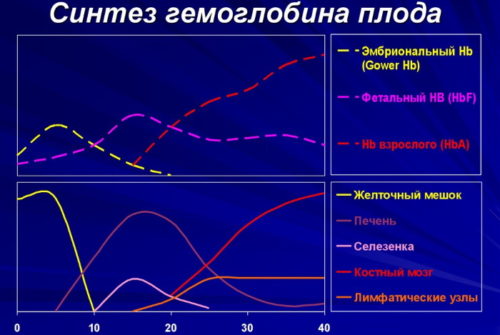
Увеличенное количество гемобелка hbf указывает на талассемию (патологическое изменение полипептидных цепочек форменных элементов крови), предрасположенность к заболеваниям дыхательной системы и анемиям различного типа, возможность развития лейкоза и состояний, при которых нарушается распределение кислорода по организму. Определить, с чем связано изменение значения, возможно только после тщательного обследования. Младенцев с отклонениями обычно ставят на учет.
Разница между гемоглобином и миоглобином
Определение
Гемоглобин: Гемоглобин — это красный белок, который отвечает за транспортировку кислорода в крови позвоночных.
Миоглобин: Миоглобин — это красный белок с гемом, который переносит и запасает кислород в мышечных клетках.
Молекулярный вес
Гемоглобин: Молекулярная масса гемоглобина составляет 64 кДа.
Миоглобин: Молекулярная масса гемоглобина составляет 16,7 кДа.
Состав
Гемоглобин: Гемоглобин состоит из четырех полипептидных цепей.
Миоглобин: Миоглобин состоит из одной полипептидной цепи.
Четвертичная структура
Гемоглобин: Гемоглобин представляет собой тетрамер, состоящий из двух α и двух β субъединиц.
Миоглобин: Миоглобин является мономером. Следовательно, ему не хватает четвертичной структуры.
Количество молекул кислорода
Гемоглобин: Гемоглобин связывается с четырьмя молекулами кислорода.
Миоглобин: Миоглобин связывается только с одной молекулой кислорода.
Кооперативное связывание
Гемоглобин: Поскольку гемоглобин является тетрамером, он проявляет кооперативное связывание с кислородом.
Миоглобин: Поскольку миоглобин является мономером, он не проявляет кооперативного связывания.
Сродство к кислороду
Гемоглобин: Гемоглобин обладает низким сродством к связыванию с кислородом.
Миоглобин: Миоглобин обладает высоким сродством связываться с кислородом, что не зависит от концентрации кислорода.
Связь с кислородом
Гемоглобин: Гемоглобин способен плотно связываться с кислородом.
Миоглобин: Миоглобин не способен тесно связываться с кислородом.
Гемоглобин: Гемоглобин находится в кровотоке.
Миоглобин: Миоглобин находится внутри мышц.
Типы
Гемоглобин: Гемоглобин А, гемоглобин А2 и гемоглобин F являются типами гемоглобина у людей.
Миоглобин: Единственный тип миоглобина обнаружен во всех клетках.
функция
Гемоглобин: Гемоглобин берет кислород из легких и транспортирует к остальной части тела.
Миоглобин: Миоглобин накапливает кислород в мышечных клетках и выделяет при необходимости.
Заключение
Гемоглобин и миоглобин являются двумя связывающими кислород глобулярными белками у позвоночных. Гемоглобин представляет собой тетрамер, который совместно связывается с четырьмя молекулами кислорода. Миоглобин — это мономер, состоящий из одной группы гемов. Поскольку связывающая способность гемоглобина выше, чем у миоглобина, гемоглобин используется в качестве транспортирующего кислород белка в крови. Миоглобин используется в качестве запасающего кислород белка в мышечных клетках. Сродство связывания кислорода с миоглобином выше, чем у гемоглобина. Основное различие гемоглобина и миоглобина заключается в их функции. Функциональное различие гемоглобина и миоглобина возникает из-за разницы их трехмерной структуры.
Нормы свободного гемоглобина для детей
В первые месяцы жизни уровень свободного гемоглобина в крови грудничка превышает 80% от общего показателя. Это связано с быстрым метаболизмом, усиленной работой почек и системы кроветворения, которая перестает зависеть от материнской. Нормальным считается показатель:
- первая неделя до 230 г/л;
- до 6 месяцев понижение до 140 г/л;
- в год после рождения 145–160 г/л.
Кроме возрастных норм, во внимание следует принимать особенности питания, введение или отсутствие прикорма. При анемии у малышей замедляется рост и развитие, плохо набирается вес, ребенок становится более раздражительным и плаксивым
В период полового созревания на уровень начинает влиять и пол, гормональные особенности.
Как диагностируют патологические формы железосодержащего белка в крови?
Как упоминалось выше, анализ на содержание гемоглобина входит в клиническое исследование сыворотки крови. В некоторых случаях показано проведение биохимии крови для точного определения патологий данного ПС.
Кровь на анализ сдается натощак и в утреннее время. Рекомендуется не употреблять пищу за 12 часов до забора биологического материала (кала, мочи, крови), чтобы не исказить результаты анализов обследования. В особенности нежелательно заниматься физическими нагрузками, употреблять психотропные вещества или другие лекарственные средства. Диеты придерживаться не нужно, однако от жирной или жареной пищи воздержаться следует, чтобы не повлиять на различные параметры в кале.
 Биологический материал
Биологический материал
Строение гемоглобина
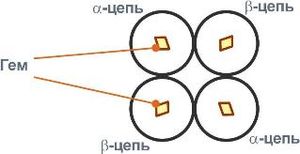
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком — контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Способы предотвращения окисления железа гемоглобина
Для поддержания здоровья стоит знать, как предотвратить образование излишнего метгемоглобина в крови. Для этой цели есть два способа.
- Предотвратить патогенное воздействие, проникших в эритроциты крови окислителей железа до того, как они повредят молекулы гемоглобина. Для этого в кровь вводится энзим глутатионпероксидаза. При этом восстановленный глутатион воздействует на патогенные окислители в крови, обезвреживает их и предотвращает синтез метгемоглобина. Данный способ поможет предотвратить дальнейшее развитие метгемоглобинемии, однако может привести к образованию в крови веществ, полученных в результате денатурации гемоглобина – телец Гейнтца.
- Восстановить повреждённые окисленным железом молекулы гемоглобина. Данный способ применяется при помощи двух ферментативных систем: НАНД-зависимой и НАНДФ-зависимой метгемоглобинредуктазы. В первой системе восстанавливающими повреждённый гемоглобин веществами выступают продукты анаэробного этапа переработки глюкозы (НАНД), во второй – гексозомонофосфатного преобразования (НАНДФ). В результате гексозомонофосфатного превращения при воздействии гексозо-6-фосфатдегидрогеназы (Г-6ф-ДГ) синтезируется восстанавливающий агент – никатинамид – адениндинуклеотд фосфат (НАНДФН). Он принимает участие в трансформации метгемоглобина в гемоглобин в присутствии НАДФН-метгемоглобинредуктазы, а также в результате восстановления окисленного трехвалентного железа при участии НАНДФ-зависимой глутатионредуктазы.
Метгемоглобин – опасное для здоровья вещество. Синтезирование гемоглобина в метгемоглобин приводит к серьезным нарушениям состава и качества крови. Во избежание концентрации его в организме необходимо систематически проводить профилактические процедуры и следить за дозировкой применяемых лекарств.
О влиянии нитратов на организм человека рассказывается в представленном видеосюжете:
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Уровень свободного гемоглобина у взрослых
У людей старше 18 лет показатель не зависит от возраста, остается относительно стабильным при отсутствии проблем со здоровьем. Но при любых диетах, нарушениях режима дня он не должен превышать 2–4% от общего гемоглобина. Если белок проникает в плазму, у человека уменьшается количество эритроцитов, меньше кровяных телец участвует в процессе кислородного обмена.
Основная сложность при диагностике уровня свободного гемоглобина – для его определения требуется специальный комплексный анализ. Методы Бинга и спектрофотометрии предполагают выделение белков из плазмы, исследование сывороточного альбумина и холестерина. Сравнение таких показателей в динамике используется при подозрении на инсульт, инфаркт миокарда.
Нормальные показатели для женщин
Для женщины среднего возраста и комплекции нормальным считается показатель 120–150 г/л. При ежемесячной менструации он падает до 110 г/л, но быстро возвращается в норму, не требует приема специальных препаратов или витаминов. Отклонения встречаются в следующих ситуациях:
- курение;
- гормональный сбой на фоне патологий репродуктивной системы;
- менопауза;
- строгие диеты;
- физическое переутомление.
При беременности уровень свободного гемоглобина падает: организм женщины старается «задействовать» все белки в переносе кислорода. Врачи строго контролируют этот показатель, чтобы не допустить гипоксии плода, патологий развития нервной системы. Но и превышение нормы в 140 г/л несет опасность тромбоза, варикозного расширения вен, тромбоэмболии легких во время родоразрешения.
Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
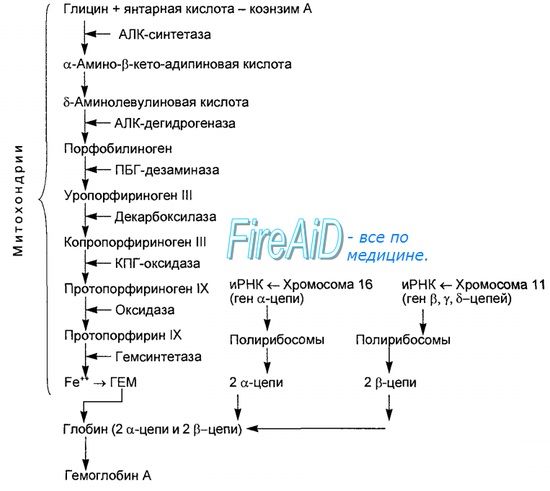
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2.
Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
– Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.”