Бактериофаг
Содержание:
- Классификация бактериофагов
- Инструкция на Бактериофаг стафилококковый (Способ и дозировка)
- Две стороны медали
- Взаимодействие бактериофага с бактериальными клетками
- Диагностическая и терапевтическая роль фагов
- Клиническое значение
- История
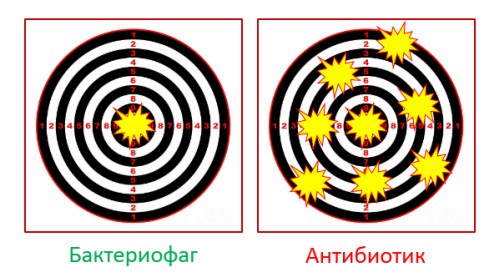
- Отличия бактериофагов и антибиотиков
- Определение фаговых частиц в 1 мл по методу Грациа (на плотных питательных средах двухслойным методом)
- Фаготерапия по-русски
- История открытия
- Заключение
Классификация бактериофагов
Специфичность фагов послужила основанием для их наименования по видовым и родовым названиям чувствительных к ним бактерий. Так, например, фаги, лизирующие стрептококки, называются стрептококковыми, лизирующие холерные вибрионы -холерные, стафилококки — стафилококковыми. По признаку специфичности выделяют поливалентные бактериофаги, лизирующие культуры одного семейства или рода бактерий, моновалентные (монофаги) — лизирующие культуры только одного вида бактерий, а также отличающиеся наиболее высокой специфичностью — типовые бактериофаги, способные вызывать лизис только определенных типов (вариантов) бактериальной культуры внутри вида бактерий.
Наборы таких типоспецифических фагов используются для дифференцировки бактерий внутри вида — это метод фаготи-пирования бактерий. С помощью этого метода можно установить источник и пути передачи инфекционного заболевания, т. е. провести его эпидемиологический анализ, поскольку он позволяет сравнивать фаготипы (фаговары) чистых культур бактерий, выделенных в ходе бактериологического исследования от больного и от окружающих его лиц — возможных бактерионосителей.
Фаги получают индукцией из лизогенных культур или из объектов, содержащих соответствующие бактерии, при культивировании на жидкой питательной среде с последующим выделением из культуральной жидкости путем фильтрования через бактериальные фильтры. Активность полученного (выделенного) фага определяют путем титрования или определения количества фаговых частиц в единице объема среды методом агаровых слоев по Трациа. Суть его состоит в том, что на газон чувствительной культуры (первый слой) наносят определенное разведение фага в полужидком агаре (второй слой). Каждая фаговая частица, размножаясь на бактериальном газоне, образует на поверхности выросшей культуры стерильное пятно («бляшка», или негативная колония фага). Таким образом, по количеству стерильных пятен можно подсчитать количество фаговых частиц в единице среды (титр фага).
Инструкция на Бактериофаг стафилококковый (Способ и дозировка)
Препарат вводится в очаг инфекции. Кратность введений и их размер устанавливают с помощью определения клинической формы заболевания, характера инфекционного очага и стандартных рекомендаций. Средняя длительность лечения составляет 5-15 дней. При случаях рецидивов возможно проведение дополнительных курсов лечения. Инструкция по применению бактериофага стафилококкового для детей и для взрослых несколько отличается. Рекомендации по применению препарата для детей приведены в конце раздела.
Жидкий фаг разрешено применять местно в виде примочек, орошения или тампонирования в объеме до 200 мл учитывая размеры участка поражения. Также для местного применения служит мазь.
Терапию гнойно-воспалительных ограниченных поражений целесообразно проводить как местным, так и пероральным способом в течении 1-4 недель.
При гнойно-воспалительных поражениях горла, уха или носа препарат применяют для полоскания, закапывания, промывания и введения смоченных турунд по 2-10 мл до трех раз в день.
При карбункулах и фурункулах жидкий бактериофаг инъецируется непосредственно в очаг или вокруг него, ежедневно по 0,5-2 мл. Всего за курс лечения производят до 5 инъекций.
Лечение хронических остеомиелитов осуществляют вливанием препарата в рану сразу после хирургической обработки.
При абсцессах бактериофаг инъекционно вводится в полость, опустошенного от гноя очага. При вскрытии абсцесса в рану вводят тампон, смоченный препаратом.
Лечение глубокого пиодермита осуществляют произведением внутрикожных инъекций средства в одно место по 0,1-0,5 мл или в несколько мест в суммарной дозе до 2 мл. Введения производят каждые 24 часа, всего 10 инъекций.
Для введения в брюшную, плевральную, суставную полости используют капиллярный дренаж, вводят до 100 мл бактериофага через день. Всего 3-4 таких введения.
При циститах средство вводят в мочевой пузырь с помощью катетера.
При гнойных бурситах, плевритах или артритах препарат вводят в полость, предварительно опустошенную от гноя по 20 мл через день. Курс лечения составляет 3-4 введения.
Также Стафилококковый бактериофаг используют перорально в виде таблеток при лечении урогенитальных инфекций (цистита, пиелонефрита, пиелита, сальпингоофорита, эндометрита), кишечных инфекций и иных заболеваний, вызванных стафилококком.
Как применять Бактериофаг стафилококковый при кишечных стафилококковых поражениях и дисбактериозе кишечника: препарат используют перорально внутрь натощак трижды в сутки за 2 часа до еды; ректально в виде свечей или клизм препарат назначают один раз вдень. Лечение проводят 7-10 дней.
Новорожденным детям в первые 2 приема препарат разводят равным количеством воды. Также его можно перемешивать с грудным молоком.
При сепсисе или энтероколите у новорожденных средство применяют постановкой высоких клизм до трех раз в сутки. Разрешено сочетание ректального и орального применения.
При терапии пиодермий, омфалитов, гнойных ран у новорожденных препарат используют в виде аппликаций дважды в день и в виде таблеток – по 1 штуке до четырех раз в день. Мазь используют локально с повязками по 5-20 грамм до двух раз в день.
При профилактике энтероколита и сепсиса у новорожденных при опасности развития госпитальной инфекции или внутриутробном инфицировании препарат используют в виде клизм дважды в день на протяжении недели.
В аэрозольной форме Бактериофаг стафилококковый используют с целью орошения пораженных слизистых оболочек и кожи при гнойно-воспалительных поражениях, ожогах, септических ранах и ангине.
Наиболее обосновано применение данного средство в случаях инфицирования антибиотикоустойчивыми штаммами.
Две стороны медали
Достоинства
Бактерии теряют чувствительность к действию антибиотиков. Фармацевтическая промышленность неустанно синтезирует другие. Однако известно, что возможности синтеза антибиотиков ограничены. К действию бактериофагов антибиотики приспосабливаются очень тяжело, а, как утверждают специалисты, к комплексу из нескольких бактериофагов микробы не могут выработать резистентность и вовсе. Кроме того, бактериофаги практически не имеют побочного действия, реже вызывают аллергические явления, могут сочетаться с любыми препаратами. Бактериофаги в настоящий момент хорошо зарекомендовали себя при лечении урологических заболеваний, гнойных процессов в хирургии, а также при лечении инфекционных заболеваний кишечника у новорожденных детей.
Недостатки
- К сожалению, недостатков у медицинских бактериофагов тоже немало. Самая главная проблема проистекает из достоинства – высокой специфичности фагов. Каждый бактериофаг инфицирует строго определенный тип бактерий, даже не таксономический вид, а ряд более узких разновидностей, штаммов. Условно говоря, как если бы сторожевая собака начинала лаять только на одетых в черные плащи громил двухметрового роста, а на лезущего в дом подростка в шортах никак не реагировала. Поэтому для нынешних фаговых препаратов нередки случаи неэффективного применения. Препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерове. Болезнь та же, вызывается тем же микробом, а штаммы стрептококка в разных регионах оказываются различными.
Для максимально эффективного применения бактериофага необходима точная диагностика патогенного микроба, вплоть до штамма. Самый распространенный сейчас метод диагностики – культуральный посев – занимает много времени и требуемой точности не дает. Быстрые методы – типирование с помощью полимеразной цепной реакции или масс-спектрометрии – внедряются медленно из-за дороговизны аппаратуры и более высоких требований к квалификации лаборантов. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать против инфекции каждого конкретного пациента, но это дорого и на практике неприемлемо.
- Другой важный недостаток фагов – их биологическая природа. Кроме того, что бактериофаги для поддержания инфекционности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто.
- Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение – проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, – на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника – то проблем не возникает.
- Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Нужно отметить, что противопоставлять применение бактериофагов и антибиотиков в медицинских целях не следует. При совместном их действии наблюдается взаимное усиление противобактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Соответственно, и механизм выработки у бактерий устойчивости к обоим компонентам комбинированного лекарства почти невозможен.
Расширение арсенала противомикробных препаратов дает больше степеней свободы в выборе методики лечения. Таким образом, научно обоснованное развитие концепции применения бактериофагов в противомикробной терапии – перспективное направление. Бактериофаги служат не столько альтернативой, сколько дополнением и усилением в борьбе с инфекциями.
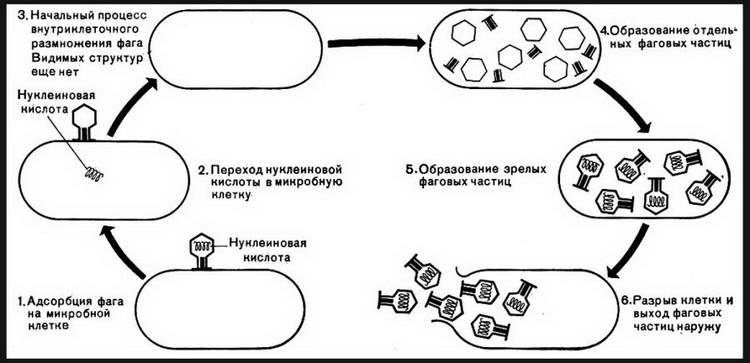
Взаимодействие бактериофага с бактериальными клетками
По характеру
взаимодействия бактериофага с
бактериальной клеткой различают
вирулентные и умеренные фаги. Вирулентные
фаги могут только увеличиваться в
количестве посредством литического
цикла. Процесс взаимодействия вирулентного
бактериофага с клеткой складывается
из нескольких стадий: адсорбции
бактериофага на клетке, проникновения
в клетку, биосинтеза компонентов фага
и их сборки, выхода бактериофагов из
клетки.
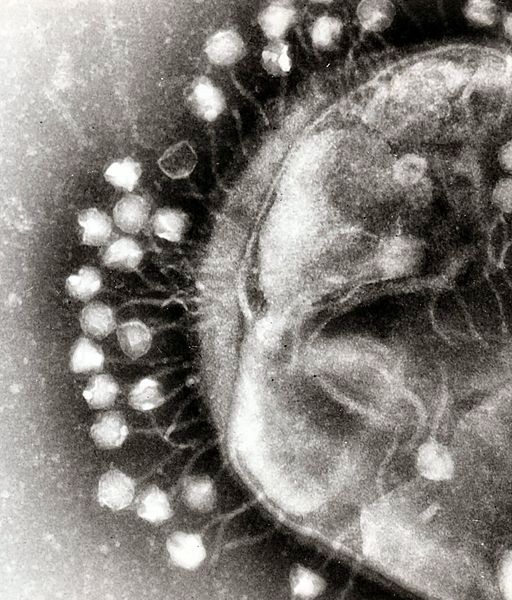
Рис. 3. Адсорбция
бактериофагов на поверхности бактериальной
клетки
Первоначально
бактериофаги прикрепляются к
фагоспецифическим рецепторам на
поверхности бактериальной клетки. Хвост
фага с помощью ферментов, находящихся
на его конце (в основном лизоцима),
локально растворяет оболочку клетки,
сокращается и содержащаяся в головке
ДНК инъецируется в клетку, при этом
белковая оболочка бактериофага остается
снаружи. Инъецированная ДНК вызывает
полную перестройку метаболизма клетки:
прекращается синтез бактериальной ДНК,
РНК и белков. ДНК бактериофага начинает
транскрибироваться с помощью собственного
фермента транскриптазы, который после
попадания в бактериальную клетку
активируется. Синтезируются сначала
ранние, а затем поздние иРНК, которые
поступают на рибосомы клетки-хозяина,
где синтезируются ранние (ДНК-полимеразы,
нуклеазы) и поздние (белки капсида и
хвостового отростка, ферменты лизоцим,
АТФаза и транскриптаза) белки бактериофага.
Репликация ДНК бактериофага происходит
по полуконсервативному механизму и
осуществляется с участием собственных
ДНК-полимераз. После синтеза поздних
белков и завершения репликации ДНК
наступает заключительный процесс —
созревание фаговых частиц или соединение
фаговой ДНК с белком оболочки и образование
зрелых инфекционных фаговых частиц.
Продолжительность
этого процесса может составлять от
нескольких минут до нескольких часов.
Затем происходит лизис клетки, и
освобождаются новые зрелые бактериофаги.
Иногда фаг инициирует лизирующий цикл,
что приводит к лизису клетки и освобождению
новых фагов. В качестве альтернативы
фаг может инициировать лизогенный цикл,
при котором он вместо репликации обратимо
взаимодействует с генетической системой
клетки-хозяина, интегрируясь в хромосому
или сохраняясь в виде плазмиды. Таким
образом, вирусный геном реплицируется
синхронно с ДНК хозяина и делением
клетки, а подобное состояние фага
называется профагом. Бактерия, содержащая
профаг, становится лизогенной до тех
пор, пока при определенных условиях или
спонтанно профаг не будет стимулирован
на осуществление лизирующего цикла
репликации. Переход от лизогении к
лизису называется лизогенной индукцией
или индукцией профага. На индукцию фага
оказывает сильное воздействие состояние
клетки хозяина предшествующее индукции,
также как наличие питательных веществ
и другие условия, имеющие место быть в
момент индукции. Скудные условия для
роста способствуют лизогенному пути,
тогда как хорошие условия способствуют
лизирующей реакции.
Очень важным
свойством бактериофагов является их
специфичность: бактериофаги лизируют
культуры определенного вида, более
того, существуют так называемые типовые
бактериофаги, лизирующие варианты
внутри вида, хотя встречаются поливалентные
бактериофаги, которые паразитируют в
бактериях разных видов.
Диагностическая и терапевтическая роль фагов
Фаги могут применяться в качестве диагностических препаратов для установления рода и вида бактерий, выделенных в ходе бактериологических исследования. Однако чаще всего их используют для лечения и профилактики некоторых инфекционных заболеваний (перорально или местно). Активность фага выражают числом частиц фага, содержащихся в 1 мл или 1 таблетке. Лечебное и профилактическое действие фагов основано на их литической активности.
Отличительной чертой бактериофагов как терапевтических средств является почти полное отсутствие у них побочного действия, что позволяет назначать эти препараты различным возрастным группам без каких-либо ограничений, и возможность назначения поливалентных бактериофагов до получения результатов бактериологического исследования. Препараты диагностических бактериофагов вводить категорически запрещается. В настоящее время в России для фаготерапии и фагопрофилактики производятся и используются:
- поливалентный сальмонеллезный бактериофаг;
- моновалентные бактериофаги — брюшнотифозный, дизентерийный, протейный, синегнойный, холерный, стафилококковый, стрептококковый, коли-фаг (кишечной палочки);
- комбинированные препараты поливалентных бактериофагов — колипротейный, пиобактериофаг (включающий стафилококковые, стрептококковые, клебсиеллезные, эшерихиозные, протейные и синегнойные бактериофаги) и др.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется фагом, кодирующим токсин. Примерами являются холерный токсин в Vibrio cholerae, дифтерийный токсин в Corynebacterium diphtheriae, ботулинический нейротоксин в Clostridium botulinum, бинарный токсин в Clostridium difficile, и шига-токсин из видов Shigella. Без токсинов, кодируемых фагами, эти виды бактерий либо гораздо менее патогенны, либо вовсе не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как токсин холеры, вероятно, помогает как фагу, так и хозяину достичь своей следующей жертвы, вызывая обильную, водянистую диарею, паралич, возникающий в результате ботулинического токсина, по-видимому, имеет обратный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам. Они также были разработаны для введения генов в определенные штаммы для получения клинического эффекта, хотя их использование в настоящее время находится на стадии тестирования.
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение может использоваться в качестве биомаркера присутствия их хозяина в сложном образце окружающей среды. Чаще всего они используются в качестве суррогата фекального загрязнения водных источников. Если фаг присутствует, то, скорее всего, присутствует и хозяин. С другой стороны, фаги были сконструированы так, чтобы производить детектируемую молекулу, такую как люцифераза, когда они заражают своего хозяина, как средство обнаружения бактерий в смешанном образце окружающей среды .
Хотя бактериофаги в основном вытесняются новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, но не к другим. Путем систематического заражения каждого штамма стандартной панелью фагов для этого вида можно идентифицировать каждый штамм по типу чувствительности и устойчивости к каждому типу фагов. Для типирования фагов Staphylococcus aureus, например, использовалась стандартизированная панель бактериофагов, распространенная на международном уровне, для дифференциации штаммов S. aureus. До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в импульсном поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях.
Наконец, бактериофаги были первым обнаруженным типом вируса и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательство того, что ДНК была молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
История
Английский бактериолог Фредерик Туорт в статье 1915 года описал инфекционную болезнь стафилококков, возбудитель которой проходил через фильтры, и его можно было переносить от одной колонии к другой.
Независимо от Фредерика Туорта французско-канадский микробиолог Феликс Д’Эрелль 3 сентября 1917 года сообщил об открытии бактериофагов. Наряду с этим известно, что российский микробиолог Николай Фёдорович Гамалея ещё в 1897 году впервые наблюдал явление лизиса бактерий (сибиреязвенной палочки) под влиянием перевиваемого агента.
После открытия явлений бактериофагии Д’Эрелль развил учение о том, что бактериофаги патогенных бактерий, являясь их паразитами, играют большую роль в патогенезе инфекций, обеспечивая выздоровление больного организма, а затем создания специфического иммунитета
Это положение привлекло к явлению бактериофагии внимание многих исследователей, которые предполагали найти в фагах важное средство борьбы с наиболее опасными инфекционными болезнями человека и животных.. Также Феликс Д’Эрелль выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов
Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации
Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
Также Феликс Д’Эрелль выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
Отличия бактериофагов и антибиотиков
1. Фаг «бьет» точно в цель, как снайпер. Действие антибиотика – это «бомбежка» по местности, где есть свои и чужие.
Поэтому антибиотики часто вызывают дисбиоз кишечника. Фаги – нет.
2. Антибиотики обязательно действуют и на другие органы.
Например, так любимый многими докторами Амоксиклав может привести к антибиотико-ассоциированному колиту, гепатиту, интерстициальному нефриту.
Цефалоспорины «сажают» печень, почки, могут вызвать изъязвления слизистой рта.
Сумамед тоже не лучшим образом действует на печень, почки, может давать побочные в виде сердцебиения, головокружения, головной боли, сонливости.
Отличия антибиотиков от бактериофагов я собрала в этой таблице:
Определение фаговых частиц в 1 мл по методу Грациа (на плотных питательных средах двухслойным методом)
Мясопептонный 1,5 % агар разливают в чашки Петри по (20 ± 2) мл (первый слой). Перед использованием чашки с агаром подсушивают в перевернутом виде с прикрытой крышкой при температуре (37 ± 1) °С в течение 30-60 мин. Для титрации используют посевные штаммы бактерий. Готовят десятикратные последовательные разведения маточного фага в МПБ по методу Аппельмана от 10— 1 до 10-8 (10-9 или выше, в зависимости от специфической направленности бактериофага). Затем смешивают 1 мл разведенного фага из пробирок с разведениями 10-6, 10-7, 10-8 разведений с 5 мл расплавленного и остуженного до температуры 45 °С 0,7 % мясопептонного агара. Затем добавляют (0,2 ± 0,05) мл 18-часовой бульонной культуры посевного штамма, подготовленного из суточной культуры, выращенной на плотной питательной среде, в соответствии с требованиями к производственным бактериальным штаммам. Содержимое пробирок быстро перемешивают вращением пробирок между ладонями, чтобы не произошло застывания агара, и выливают вторым слоем на поверхность 1,5 % агара в чашках Петри. После застывания верхнего слоя агара чашки инкубируют в течение 18 ч при температуре (37 ± 1) °С. Для определения концентрации фаговых частиц в маточном фаге подсчитывают количество негативных колоний (прозрачные пятна на матовом фоне глубинного роста бактерий) в каждой чашке, умножают на коэффициент разведения фага в пробирке с соответствующим разведением. Затем вычисляют среднее значение 3 определений.
Данная методика используется при отборе перспективных фаговых рас в коллекцию маточных бактериофагов. От вида бактериофагов зависит порядок применяемых в опыте разведений.
Фаготерапия по-русски
Эксперты отмечают, что производство бактериофагов – весьма перспективное направление в фармацевтической промышленности. Кстати, наша страна в производстве бактериофагов исторически занимает ведущие позиции. Уже в годы Великой Отечественной войны применялась фаготерапия
Особое внимание уделялось разработке бактериофагов против кишечных инфекций – холеры, брюшного тифа, дизентерии и сальмонеллеза. Всего в военное время для фронта было изготовлено более 200 тыс
литров бактериофагов.
Сегодня в нашей стране развитие производства лекарственных препаратов на основе бактериофагов входит в Стратегию предупреждения распространения антимикробной резистентности в Российской Федерации до 2030 года, принятую Правительством РФ. Единственный в стране производитель препаратов бактериофагов – компания «Микроген» холдинга «Нацимбио» Госкорпорации Ростех. В период с 2017 по 2019 год продажи бактериофагов «Микрогена» выросли более чем на 25% в денежном выражении.
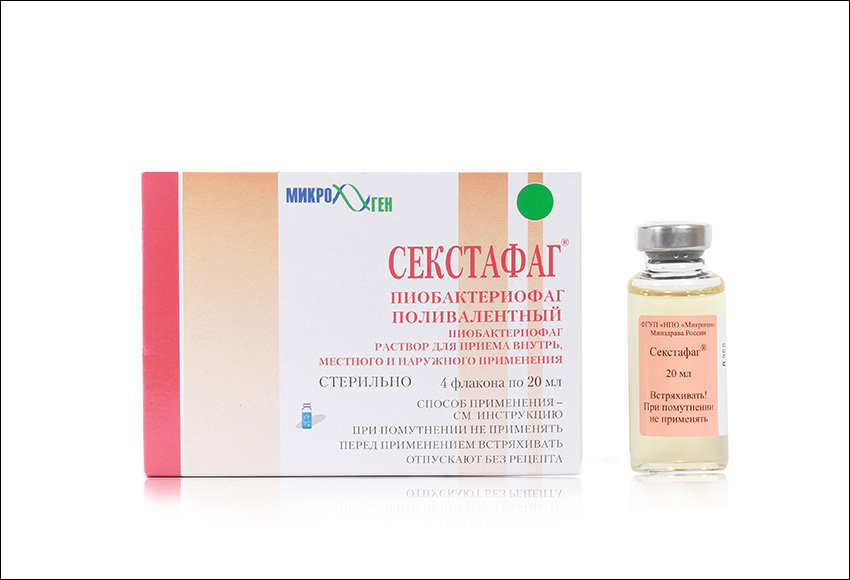
Компанией разработаны и выпускаются 19 наименований лекарств на основе бактериофагов против множества известных возбудителей инфекционных заболеваний: дизентерии, брюшного тифа, сальмонеллеза, гнойно-септических и других. Кроме того, разработаны комбинированные препараты, например «Секстафаг» (Пиобактериофаг поливалентный). Он обладает способностью справиться с бактериями стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек. Данный препарат отличается высокой степенью очистки от бактериальных метаболитов, что позволяет успешно использовать его для лечения новорожденных и детей раннего возраста, а также применять для беременных.
В рамках Стратегии по борьбе с антимикробной резистентностью ученые НПО «Микроген» проводят множество исследований. В настоящий момент предприятие приступило к созданию первого в России Биологического ресурсного центра для углубленного изучения бактериофагов.
«Задача Биологического ресурсного центра – объединить микробные производственные коллекции, собранные на территории России. На данный момент это более 10 тыс. штаммов. В коллекцию также входят бактериофаги для терапевтических целей. Это уникальный материал, представляющий собой государственную ценность, на его основе удастся создать новые виды лекарств», – прокомментировал исполнительный директор Госкорпорации Ростех Олег Евтушенко.
Но, пожалуй, самой амбициозной целью нового центра является создание основы для перехода к персонализированной фаготерапии в ближайшие 5-7 лет. Персонально подобранный «коктейль» из бактериофагов может спасти жизнь пациентам, которым уже не помогают антибиотики.
Успехи российских и зарубежных ученых вселяют надежду на то, что проблема антимикробной резистентности в скором времени может быть преодолена. Тем временем каждый из нас в этой борьбе с «супербактериями» может внести свой маленький вклад – соблюдать правила, которые помогут уберечься от вирусов и бактерий, остановить появление новых опасных инфекций. Все просто: не забывать о гигиене, вести здоровый образ жизни, вовремя обращаться к врачам и ограничить использование антибиотиков.
История открытия

Исследователь бактериологии Ф. Туорт создал описание инфекционного заболевания, которое предложил в статье, выпущенной в 1915 году. Данная болезнь поражала стафилококки и могла проходить сквозь любые фильтры, а также могла транспортироваться из одной колонии клеток в другие.
Микробиолог родом из Канады Ф. Д’Эрелль совершил открытие бактериофагов в сентябре 1917 года. Их обнаружение было сделано независимо от трудов Ф. Туорота.
В 1897 г. Н. Ф. Гамалея стал наблюдателем явления лизиса бактерии, который протекал под воздействием процесса прививки агента.
Вирусы бактерий – бактериофаги-паразиты, играющие огромную роль в процессе патогенеза инфекций. Они заняты обеспечением выздоровления организма многоклеточного типа от многих болезней, и потому образуют специфический тип иммунной системы. Впервые об этом заговорил Д’Эрелль, а позднее развил это в учение
Данное положение привлекло множество ученых, которые начали исследовать эту область и пытаться найти ответы на такие вопросы, как: какое клеточное строение (кристаллы) имеют бактерии-вирусы бактериофаги? Каковы процессы внутри них, их дальнейшая судьба и развитие? Все это и многое другое привлекло внимание множества исследователей
Заключение
Не всегда бактериофаги могут заменить антибиотики. Так, если имеет место острая ситуация, когда заподозрена бактериальная инфекция, но нет времени определить бактериальный фон болезни, чтобы подобрать препарат бактериофаг, то применяется лечение антибиотиками. При хронических инфекционных болезнях, когда установлена нечувствительность бактерий к антибиотикам и бактериальный фон заболевания, предпочтение следует отдать бактериофагам.
Хотя бактериофаги, возможно, не смогут полностью заменить антибиотики, но вместе они могут бороться со многими серьезными болезнями в клинической практике.