Расшифровка обозначений в анализе крови
Содержание:
- Химики видят вещества изнутри
- Физические свойства
- Ферретаб комп.
- Признаки снижения
- Соль Мора
- Сплавы
- Биологическое значение железа
- Продукты, содержащие цинк в большом количестве: таблица
- Типы железных руд
- Нехватка железа — симптомы
- Препараты трехвалентного железа
- Железосодержащие продукты
- Способы добычи
- Как препараты железа влияют на зубы?
- Разновидности сплавов на основе железа
- Ферлатум
- Применение железа:
- Комплексные соединения
Химики видят вещества изнутри
Химики видят вещества с иной стороны. Они знают, что железо, ртуть и свинец, могут выглядеть иначе. В лабораторных условиях можно придать металлам газообразное состояние. Да, и даже тяжелые металлы, такие, как свинец и ртуть, могут летать.
Для этого используется специальное оборудование, в котором металлы закипают, превращаясь в газ. Ртуть закипает при 356,73°C, свинец при 1749°C, железо, при 2862°C. При этом происходит вполне стандартное кипение веществ со сменой кристаллической решетки и выходом пара наверх. После нормализации температурных условий пар оседает, превращаясь в капли металла.
Этим обусловлена ситуация, когда одежда металлургов на соответствующих предприятиях запачкана тончайшим слоем твердых веществ, так как при высоких температурах они превращаются в пар, а затем оседают.
 В металлургии металлическая пыль — обычное дело
В металлургии металлическая пыль — обычное дело
Конечно, железо никогда не поднимется в воздух без особых условий, это удел иллюзионистов и фокусников. Но умелое обращение с земными «твердынями» доказывает, что за наукой стоит наше будущее.
Создавая новые материалы, изучая свойства уже существующих, специалисты с каждым открытием делают технологичней наш мир.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, оно имеет четыре кристаллические модификации:
- до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа);
- в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмно-центрированной кубической решётки и магнитными свойствами парамагнетика;
- в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой;
- выше 1394 °C устойчиво δ-Fe с объёмно-центрированной кубической решёткой.
Металловедение не выделяет β-Fe как отдельную фазу, и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
- от абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой;
- от 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой;
- от 1400 до 1539 °C устойчива δ-модификация с объёмно-центрированной кубической (ОЦК) кристаллической решёткой.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо—углерод). Твёрдый раствор углерода в α- и δ-железе называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы. Твёрдый раствор углерода в γ-железе называется аустенитом.
В области высоких давлений (свыше 13 ГПа, 128,3 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали
Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо относится к умеренно тугоплавким металлам. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Ферретаб комп.
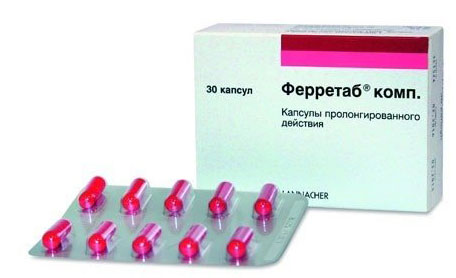
Форма выпуска – капсулы пролонгированного действия.
Интересен тем, что в каждой капсуле – три минитаблетки железа (всего 50 мг чистого железа) и одна минитаблетка фолиевой кислоты в хорошей дозировке (500 мкг).
Смотрите:

Полагаю, что сокращение «комп.» в названии препарата означает «комплекс».
Его оптимально рекомендовать при анемии, вызванной дефицитом железа и фолиевой кислоты, и при железодефицитной анемии беременных или для профилактики таковой.
Железо представлено более безопасной, чем сульфат железа, солью – фумаратом. Дает меньше побочных.
Как принимать: натощак по 1 капсуле (50 мг железа) в день. При необходимости врач может увеличить дозировку до 2-3 капсул в день.
Выводы:
Сравнив препараты двухвалентного железа, я пришла к таким выводам:
Наиболее безопасные препараты – Тотема, Ферретаб комп., т.к. они содержат не сульфат железа, а другие соли.
Наиболее адекватные дозировки железа для лечения ЖДА, на мой взгляд, в препаратах Сорбифер Дурулес и Тотема.
Признаки снижения
Состояние здоровья при снижении гемоглобина (анемии) ощутимо ухудшается.
Это выражается в упадке сил и слабости. Люди, ведущие сидячий образ жизни, не сразу ощущают эти изменения, а вот те, кто работает физически, сразу их чувствуют. Признаками анемии являются: сухость слизистых оболочек, бледность кожных покровов, болезненное воспаленное состояние поверхности языка, ломкость волос и ногтей, образование трещин в уголках рта. Если не обращать внимания на эти симптомы и не отслеживать показатели гемоглобина в анализах, могут приобрести неврологическую составляющую. В таких случаях изменяется обоняние, появляется извращение во вкусовых предпочтениях, начинаются сильные головные боли, могут воспалиться зрительные нервы и начаться парестезии. У детей наблюдаются нарушения поведенческих реакций и развития интеллекта. У пожилых пациентов снижаются адаптационные механизмы, нарушается нормальное кровоснабжение тканей, вследствие чего возникают обморочные состояния и головокружение.
Важно не только знать, как в результатах анализа гемоглобин обозначается, но и уметь повышать низкий его уровень
Соль Мора
Это соединение, которое представляет собой кристаллогидрат сульфата железа и аммония. Формула его записывается, как FeSO4*(NH4)2SO4*6H2O. Одно из соединений железа (II), которое получило широкое применение на практике. Основные области использования человеком следующие.
- Фармацевтика.
- Научные исследования и лабораторные титриметрические анализы ( для определения содержания хрома, перманганата калия, ванадия).
- Медицина — как добавка в пищу при нехватке железа в организме пациента.
- Для пропитки деревянных изделий, так как соль Мора защищает от процессов гниения.
Есть и другие области, в которых находит применение это вещество. Название свое оно получило в честь немецкого химика, впервые обнаружившего проявляемые свойства.
Сплавы
Ориентироваться в море сплавов железа (сталей, чугунов) помогает маркировка. Она поможет определить состав сплава, количество углерода и легирующие элементы, отличить их свойства.

Общую характеристику можно дать по химическому составу: это углеродистая и легированная стали.
Стали делят по применению:
| Вид и марки стали | Применение |
| Строительная Ст0-3 | Вторичные элементы конструкций, малоответственные делали (перила, настилы) |
| Строительная Ст3 | Можно использовать для несущих конструкций, но при плюсовых температурах |
| Конструкционная Ст20 | Малонагруженные детали |
| Легированная 10ХСНД | Используют в сварных конструкциях судо- и вагоностроения, химическом машиностроении |
| Легированная 18ХГТ | Выдерживает ударные нагрузки, высокое давление |
| Легированная 09Г2С | Для работы под давлением, при температурах от -70 до +450 градусов. |
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 78 % являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных). Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК. Неорганические соединения железа встречаются в некоторых бактериях, иногда используется ими для связывания азота воздуха
В организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свёкла). Интересно, что некогда шпинатошибочно был внесён в этот список (из-за опечатки в результатах анализа — был потерян «лишний» ноль после запятой). Суточная потребность человека в железе следующая: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг. У женщин потребность несколько выше, чем у мужчин. Как правило, железа, поступающего с пищей, вполне достаточно, но в некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген,ферроплекс). Суточная потребность в железе мала и её легко удовлетворить. В то время, как некоторые исследователи считают, что кормление грудью приводит к дефициту железа, есть множество исследований, показывающих, что это не так и дети, которых кормят грудью, усваивают железо намного лучше. В организме легко восстанавливается равновесие между поступлением и выведением железа, и временный дефицит его легко восполняется за счет имеющихся запасов. Потребность в железе значительно возрастает при анемии, вызванной, например, такими паразитарными инвазиями, как малярия и анкилостомоз, которые очень широко распространены в тропических странах. Содержание железа в воде больше 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени (гемохроматоз). ПДК железа в воде 0,3 мг/л. Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Продукты, содержащие цинк в большом количестве: таблица
Мы представляем вашему вниманию продукты, содержащие цинк в большом количестве: таблица очень простая, поэтому вы сможете быстро составить себе план питания, включив в него список продуктов, содержащие цинк в большом количестве.
| Название продукта | Название продукта |
Кол-во цинка в мг на 100г продукта |
|
| Дрожжи для выпечки | 9,97 | Кунжутное семя | 7,75 |
| Тыквенные семечки | 7,44 | Куриные сердца вареные | 7,30 |
| Говядина отварная | 7,06 | Арахис | 6,68 |
| Какао-порошок | 6,37 | Семечки подсолнечника | 5,29 |
| Язык говяжий,отварной | 4,80 | Кедровые орехи | 4,62 |
| Мясо индейки гриль | 4,28 | Попкорн | 4,13 |
| Яичный желток | 3,44 | Пшеничная мука грубого помола | 3,11 |
| Грецкие орехи | 2,73 | Арахисовое масло | 2,51 |
| Кокосовый орех | 2,01 | Сардины | 1,40 |
| Фасоль отварная | 1,38 | Чечевица отварная | 1,27 |
| Котлеты из речнойрыбы | 1,20 | Зеленый горошек отварной | 1,19 |
| Яйца | 1,10 | Горох вареный | 1,00 |
| Лосось консервированный | 0,92 | Тунец в масле | 0,90 |
| Грибы вареные | 0,87 | Тофу | 0,80 |
| Шпинат отварной | 0,76 | Курага | 0,74 |
| Коричневый рисвареный | 0,63 | Пшеничная каша | 0,57 |
| Вермишель | 0,53 | Овсяная каша | 0,49 |
| Кукуруза | 0,48 | Белый рис вареный | 0,45 |
| Молоко 1% жирности | 0,39 | Зеленый лук | 0,39 |
| Броколли вареная | 0,38 | Цветная капуста вареная | 0,31 |
| Авокадо | 0,31 | Редис | 0,30 |
| Морковь вареная | 0,30 |
Самое эффективное средство в борьбе с курением
Зачем нужен цинк.
Цинк играете важнейшую роль в сохранении нашего здоровья. Этот микроэлемент жизненно необходим для нормального обмена веществ и содержится в каждой клетке. Он участвует в работе более 300 клеточных ферментов. Больше всего цинка содержится в яичниках, простате, сперме, а так же печение, сердце и мозге.
Основные симптомы недостатка цинка в организме.
Хорошее самочувствие и крепкий иммунитет — это то, что дает нам цинк. Если вы недополучаете цинка с продуктами питания, то могут развиться следующие неприятные симптомы:
Аллергические реакции, дерматиты, замедление заживления ран;
Снижение иммунитета, частые простудные заболевания;
Могут отмечаться нарушения репродуктивной функции, преждевременные роды, рождение ослабленных детей с низким весом;
У подростков может отмечаться замедление умственного развития, склонность к алкоголизму, депрессиям;
Нарушение роста волос, ухудшение состояния ногтей, кожи;
Снижение вкуса и обоняния.
Суточная норма потребления цинка.
Дети: 1-3 года — 3 мг в день
4-8 лет — до 5 мг
9-13 лет — 8 мг
Женщины:
14-18 лет — 9-12мг
19-50 лет — 9-12 мг
Старше 50 лет — до 10 мг
Беременные — 14 мг в день
Мужчины:
14-18 лет — 11 мг
старше 19 лет — 15 мг.
Старше 50 лет — до 13мг
В каких продуктах больше всего цинка.
Цинк в большом количестве содержится в морепродуктах и мясных продуктах. Много цинка в отрубях, семечках и орехах. А вот во фруктах и овощах цинка недостаточно. Поэтому вегетарианцам нужно обязательно включать в рацион яйца, сыры или специальные препараты цинка.
Таблица продуктов с высоким содержанием цинка на 100 грамм
|
Наименования продуктовых позиций |
Доля цинка (1 мг) на 100 г. употребляемых в пищу продуктов |
|
Мясные продукты |
|
|
Жареная телячья печень |
16,0 |
|
Тушеная говядина |
9,5 |
|
Вареные сердечки кур |
7,3 |
|
Жареная печень барана |
5,9 |
|
Язык отварной говяжий |
4,8 |
|
Жареные почки барана |
3,6 |
|
Морепродукты |
|
|
Устрицы |
60,0 |
|
Вареные угри |
12,0 |
|
Масляные анчоусы |
3,5 |
|
Консервированный лосось |
0,9 |
|
Орехи и сухофрукты |
|
|
Орехи кедровые |
6,5 |
|
Пекан |
5,3 |
|
Орех бразильский |
4,0 |
|
Орех арахисовый |
2,8 |
|
Орех грецкий |
2,7 |
|
Миндаль |
2,2 |
|
Кешью |
2,1 |
|
Кокос |
2,0 |
|
Орех лесной |
1,9 |
|
Орехи фисташковые |
1,4 |
|
Курага |
0,75 |
|
Чернослив |
0,45 |
|
Овощи и фрукты |
|
|
Кольраби |
3,5 |
|
Капуста цветная |
0,3 |
|
Авокадо |
0,3 |
|
Редис |
0,3 |
|
Вареная морковь |
0,3 |
|
Зерновые и бобовые продукты, семена |
|
|
Отруби из пшеницы |
16,0 |
|
Семя мака |
8,1 |
|
Семя кунжута |
7,8 |
|
Семечки тыквы |
7,5 |
|
Семечки подсолнуха |
5,6 |
|
Семя льна |
5,5 |
|
Мука из сои |
4,9 |
|
Соя, сухие бобы |
4,2 |
|
Сухая чечевица |
3,8 |
|
Попкорн |
3,4 |
|
Сухой горох |
3,3 |
|
Мука из пшеницы (грубый помол) |
3,1 |
|
Сухие белые бобы |
2,6 |
|
Вареная фасоль |
1,4 |
|
Макаронные изделия |
0,55 |
|
Овсяные хлопья |
0,5 |
|
Кукуруза |
0,5 |
|
Вареный белый рис |
0,45 |
|
Продукты растительного, грибкового и животного происхождения |
|
|
Сухие дрожжи |
8,0 |
|
Желток от яйца |
3,9 |
|
Гриб белый |
1,5 |
|
Хрен |
1,4 |
|
Крапива |
1,0 |
|
Сныть (разновидность — обыкновенная) |
1,0 |
|
Лук зеленый |
0,4 |
|
Молоко |
0,4 |
Смотрите так же: продукты богатые селеном
Ника Сестринская — специально для сайта сайт
Цинк – это эссенциальный (жизненно необходимый человеку) микроэлемент, оказывающий влияние на работу большинства внутренних органов и систем человеческого организма. Содержание этого голубовато-белого пластичного металла в теле взрослого человека варьируется от 1,5 до 2 граммов. Около 62 % цинка локализуется в скелетных мышцах. Помимо того, значительные концентрации этого полезного микроэлемента присутствуют в волосах, покровных и костных тканях, сетчатке глаза, в печени и предстательной железе.
Типы железных руд
На сегодняшний день выделяется множество видов железных руд, характеристики и названия которых зависят от состава.
Наиболее часто в природе встречается такой вид, как красный железняк, в основе которого лежит оксид под названием гематит. Этот оксид содержит в составе количество железа, превышающее 70%, и минимальное количество побочных примесей.
Бурый железняк представляет собой оксид железа с содержанием воды. Его очень часто называют лимонитом. В его составе значительно меньше железа, количество которого обычно не превышает четверти. В природе такой железняк содержится в виде рыхлой, пористой породы, со значительным содержанием марганца и фосфора. Обычно обильно насыщен влагой, имеет в качестве пустой породы глину. Из него очень часто делают чугун, несмотря на незначительную часть железа, так как он очень легко перерабатывается.

Бурый железняк
Магнитные руды отличаются тем, что в их основе заложен оксид, имеющий магнитные свойства, но при сильном нагреве они теряются. Количество этого типа породы в природе ограничено, но содержание железа в нем может не уступать красному железняку. Внешне он выглядит как твердые кристаллы черно-синего цвета.
Шпатовый железняк представляет собой рудную породу, в основе которой лежит сидерит. Очень часто имеет в составе значительное количество глины. Этот тип породы относительно тяжело найти в природе, что на фоне малого количества содержимого железа делает его редко используемым. Поэтому отнести их к промышленным типам руд невозможно.

Шпатовый железняк
Кроме оксидов в природе содержаться другие руды на основе силикатов и карбонатов
Количество содержимого железа в породе очень важно для ее промышленного использования, но также важно наличие полезных побочных элементов, таких как никель, магний, и молибден
Нехватка железа — симптомы
Дефицит железа в организме выражается следующими симптомами и состояниями:
- Развитие анемии;
- Слабость, повышенная утомляемость, головокружения, постоянное желание спать;
- Ухудшение мыслительной функции и других функций головного мозга;
- Неврологические расстройства, депрессия;
- Сухость и бледность кожи;
- Повышенная сухость и ломкость ногтей;
- Сухость, ломкость, выпадение и ускоренное поседение волос;
- При малейшем понижении температуры человек ощущает сильный холод;
- Быстрый набор лишнего веса, развитие ожирения;
- Воспалительные процессы в полости рта – стоматиты, гингивиты;
- Нарушение вкусовых качеств;
- Нарушения функции пищеварения, сопровождающиеся отсутствием аппетита, тошнотой, метеоризмом;
- Геофагия – желание покушать мел, землю и другие несвойственные для человека вещества;
Причины нехватки Fe
- Некачественное питание или жесткие диеты с минимальным количеством или полным отсутствием употребления продуктов, богатых на железо. Это прежде всего отсутствие мясных продуктов и зеленых овощей;
- Голодовка;
- Злоупотребление продуктами или напитками, богатыми на кофеин, танин, оксалаты, фитиновую кислоту;
- Недостаточное поступление в организм витамина С (аскорбиновой кислоты) и витаминов группы В;
- Сильные кровопотери;
- Нарушения обменных процессов;
- Паразитарные заболевания – малярия, анкилостомоз.
Препараты трехвалентного железа
Преимущества препаратов трехвалентного железа
- Малотоксичны. Их невозможно передозировать.
- Лучше переносятся.
- Их можно принимать и до, и во время, и после еды, не боясь получить воспаление или изъязвление слизистой ЖКТ.
- Меньше лекарственных взаимодействий.
- Меньше взаимодействий с пищевыми продуктами.
Недостатки препаратов трехвалентного железа
Действуют медленнее, поэтому сроки лечения увеличиваются.
Как я уже говорила вам в прошлый раз, если требуется быстро поднять железо (предстоит операция, тяжелая степень анемии и пр.), в начале лечения врач назначит, скорее всего, препарат двухвалентного железа. В дальнейшем он может перевести больного на препарат трехвалентного железа, если он плохо переносит двухвалентное.
Разберем особенности некоторых популярных препаратов этой группы.
Железосодержащие продукты
Минерал в продуктах содержится в двух формах:
- гемовой;
- негемовой.
Первая усваивается на 10-20 процентов, вторую организм принимает лишь при определенных условиях и в объеме не более шести процентов. Гемовое железо характерно для продуктов животного происхождения, негемовое — для растительных. Поэтому при вегетарианском питании высок риск недостатка минерала в рационе даже при частом употреблении продуктов, содержащих железо.
Таблица — список продуктов, богатых железом
| Продукт | Содержание Fe, мг на 100 г |
|---|---|
| Кунжут | 16 |
| Морская капуста | 16 |
| Отруби пшеничные | 14 |
| Какао порошок | 13 |
| Белый гриб сушеный | 12,2 |
| Чечевица | 11,8 |
| Соя (зерно) | 9,7 |
| Яичный порошок | 8,9 |
| Гречиха (зерно) | 11,8 |
| Ячмень (зерно) | 7,4 |
| Горох (лущеный) | 7 |
| Печень говяжья | 6,9 |
| Желток куриного яйца | 6,7 |
| Крупа гречневая | 6,7 |
| Устрица | 6,2 |
| Семена подсолнечника | 6,1 |
| Маш | 6 |
| Почки говяжьи | 6 |
| Фасоль | 5,9 |
| Шоколад горький | 5,6 |
| Орех кедровый | 5,5 |
| Овес (зерно) | 5,5 |
| Отруби овсяные | 5,4 |
| Пшеница (зерно) | 5,4 |
| Рожь (зерно) | 5,4 |
| Арахис | 5 |
| Крупа пшеничная | 4,7 |
| Мука пшеничная | 4,7 |
| Фундук | 4,7 |
| Миндаль | 4,2 |
| Крупа овсяная | 3,9 |
| Фисташки | 3,9 |
| Кешью | 3,8 |
| Хлопья овсяные «Геркулес» | 3,6 |
| Шпинат (зелень) | 3,5 |
| Мясо кролика | 3,3 |
| Базилик (зелень) | 3,2 |
| Курага | 3,2 |
| Мидии | 3,2 |
| Халва подсолнечная | 3,2 |
| Яйцо перепелиное | 3,2 |
| Айва | 3 |
| Изюм | 3 |
| Чернослив | 3 |
| Крупа кукурузная | 2,7 |
| Крупа пшено (шлифованное) | 2,7 |
| Мясо говядина | 2,7 |
| Нут | 2,6 |
| Макароны из муки 1 сорта | 2,5 |
| Хурма | 2,5 |
| Яйцо куриное | 2,5 |
| Икра чёрная зернистая | 2,4 |
| Груша | 2,3 |
| Яблоки | 2,2 |
| Рис (зерно) | 2,1 |
| Грецкий орех | 2 |
| Мясо баранина | 2 |
| Рябина красная | 2 |
| Щавель (зелень) | 2 |
Ника Тютюнникова, фитнес-тренер, нутрициолог: «Богатый источник железа — мало обработанные продукты животного происхождения. Чемпионы по его содержанию субпродукты (печень, почки), много его в красном мясе, рыбе, яйцах, морепродуктах».
Из овощей и фруктов продукты-рекордсмены по содержанию железа:
- шпинат;
- капуста, брокколи;
- зелень;
- салат;
- семена тыквы;
- бобовые.
Зеленые листовые овощи содержат хлорофилл. Это вещество имеет структуру, близкую к гемоглобину, поэтому хорошо воспринимается организмом. Но полностью заменить гемовое железо не может.
Способы добычи
Методы и способы извлечения рудных ископаемых ресурсов из недр зависят от глубины, на которой залегает искомый материал. В этом контексте принято выделять три основных способа:

Скважинный метод (гидродобыча) – для работы таким способом специалисты бурят скважины, достигающие пластов пород. В образовавшиеся створы помещаются трубчатые конструкции, через которые мощной водной струёй производится дробление материала и её извлечение. Это наименее эффективный, косный и устаревший метод, который в наши дни используется достаточно редко.
Шахтенный метод – используется при условии, что пласты залегают более глубоко (до 900 метров). Прежде всего прорубаются шахтенные створы – от них по пласту разрабатываются штреки. Порода дробится и поступает на поверхность по специальным транспортёрам.
Карьерный метод – в отличие от скважинного, считается наиболее распространённым. Его используют для работы на средней глубине (до 300 метров). Для разработки применяются мощные экскаваторы и механизмы, дробящие породу. После дробления материал отгружают и транспортируют прямиком на обогатительный комбинат.
Как препараты железа влияют на зубы?
Препараты железа могут вызывать потемнение зубной эмали. Это касается, преимущественно, жидких форм (капли, сироп, раствор для приема внутрь) и жевательных таблеток.
Даже если в инструкции написано, что данный препарат окрашивания зубной эмали не вызывает, судя по отзывам тех, кто принимал препараты железа, иногда вызывает.
Видимо, это связано с какими-то особенностями микрофлоры полости рта или зубной эмали, потому что это бывает далеко не у всех.
Можно ли избежать потемнения зубов при приеме препаратов железа?
Можно. Для этого нужно соблюдать несколько правил:
- Таблетки, покрытые оболочкой, не раскусывать, не рассасывать, не держать во рту.
- Если человеку трудно глотать таблетки или капсулы, и он приобретает жевательные таблетки, после каждого приема нужно тщательно прополоскать рот и почистить зубы.
- Капли, сироп, раствор для приема внутрь лучше принимать через трубочку и после приема прополоскать рот.
- Предыдущий пункт у маленьких детей выполнить нереально, посему нужно дать ребенку запить препарат желательно большим количеством воды, а потом намотать на палец бинт, смочить его чистой кипяченой водой и протереть зубки.
Кто-то из вас спросил:
«А как решается проблема окрашивания зубов в жевательных таблетках?»
Обратите внимание, что форма жевательных таблеток есть только у комплексных препаратов железа, т.к. они реже, чем обычные соли железа вызывают окрашивание зубной эмали
Вероятнее всего, именно за счет иной структуры действующего вещества, когда железо окружено либо полисахаридами, либо белком.
Вас также могут спросить:
«Разрушают ли препараты железа зубы?»
Судя по отзывам – у деток иногда от них портятся зубки, но научных подтверждений этому я не нашла.
Возможно, все дело в подсластителях, которые входят в состав жидких форм, а не в самом железе.
Разновидности сплавов на основе железа
Сплав железа — это соединение, которое состоит из основного металла и дополнительных примесей. Соединения на основе этого материала называются чёрными металлами. К ним относятся:
- Сталь — соединение углерода с другими элементами. Углерода в составе сплава может содержаться до 2.14%. Выделяют конструкционные углеродистые, строительные, специальные и легированные стали.
- Чугун — смесь, которая пользуется огромной популярностью. Соединения могут содержать до 3,5% углерода. Дополнительно смеси содержать марганец, фосфор, серу.
- Перлит — смесь на основе железа. Содержит не более 0.8% углерода.
- Феррит — его называют чистым материалом. Связанно это с низким содержанием углерода, сторонних примесей (около 0.04%).
- Цементит — химическое соединение железа с углеродом.
- Аустенит — соединение с содержанием углерода до 2.14%. Дополнительно имеет сторонние примеси.

Легированная сталь
Состав и структура сплавов
Из-за большого количество соединений на основе железа была разработана маркировка, по которой можно отделить стали с высоким содержанием углерода от менее углеродистых, определить наличие основных легирующих элементов в составе материала, их количество. Зависимо от количества дополнительных элементов изменяются свойства соединений. К ним относится бор, ванадий, молибден, марганец, титан, углерод, хром, никель, кремний, вольфрам.
Характеристики смесей зависят от их структуры, состава. От этого изменяется прочность, пластичность, температура плавления, плотность, электропроводность и другие параметры. Например, структура чугуна определяет его хрупкость при ударах, больших физических нагрузках.
Свойства и маркировка сплавов
Относительно маркировки, первые цифры, которые идут на маркировке, говорят о процентном содержании углерода в составе. Далее идут заглавные буквы основных легирующих элементов. Начало маркировки могут начинать дополнительные буквы. Они указывают на назначение сплава.
Пластичность и вязкость будут уменьшаться при повышении количества углерода в составе сплава. На другие свойства металлов влияют основные легирующие элементы.
Ферлатум
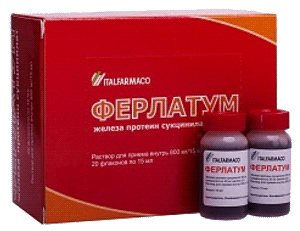
Форма выпуска: раствор для приема внутрь. В 1 флаконе — 40 мг чистого железа.
Особенности состава: это тоже комплекс, только железо находится в комплексе не с углеводами, как в предыдущем случае, а с белком. Это предупреждает повреждение слизистой оболочки желудка.
Из кишечника в кровь железо из этого комплекса поступает только благодаря белкам-переносчикам, поэтому его передозировка невозможна. Значит, и побочных будет значительно меньше, чем при лечении препаратами двухвалентного железа.
Побочные реакции: редко — диарея, запор, тошнота, боли в эпигастрии.
Лекарственное взаимодействие
- Уменьшает всасывание тетрациклинов.
- Всасываемость железа увеличивается, если принимать препарат одновременно с 200 мг аскорбиновой кислоты. Мотайте на ус! Спрашивают Ферлатум, а вы покупателю: «Аскорбиновую кислоту вам с ним врач рекомендовал принимать?» Для пущей убедительности можете показать инструкцию.
- Антациды уменьшают всасывание железа.
Детям, беременным, кормящим можно. Но беременным лучше принимать Ферлатум Фол, который в крышке-дозаторе содержит соединение фолиевой кислоты.
Нужно снять с флакона белый колпачок, утопить пальцем красную крышечку-дозатор, при этом порошок с фолиевой кислотой высыпется во флакон, и теперь препарат готов к употреблению.

Как принимать: стандартная дозировка 1-2 флакона в сутки до или после еды. Это 40-80 мг чистого железа. На мой взгляд, маловато.
Про его разведение производитель ничего не говорит, значит принимают обычно: выпили — запили водой. Имеет вишневый вкус.
Друзья, обращаю ваше внимание: я здесь указала ЛЕЧЕБНЫЕ дозировки препаратов. Но они будут другими, если препарат назначается при латентном дефиците железа или с профилактической целью
Применение железа:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
- https://en.wikipedia.org/wiki/Iron
- https://de.wikipedia.org/wiki/Eisen
- https://ru.wikipedia.org/wiki/Железо
- http://chemister.ru/Database/properties.php?dbid=1&id=236
- https://chemicalstudy.ru/zhelezo-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: Фото https://www.pexels.com, https://pixabay.com
карта сайта
железо атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле железа сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
1 399
Комплексные соединения
Очень важными в аналитической химии и не только являются особые вещества. Такие, которые образуются в водных растворах солей. Это комплексные соединения железа. Наиболее популярные и хорошо изученные из них следующие.
- Гексацианоферрат (II) калия K4[Fe(CN)6]. Другое название соединения — желтая кровяная соль. Используется для качественного определения в растворе иона железа Fe3+. В результате воздействия раствор приобретает красивую ярко-синюю окраску, так как формируется другой комплекс — берлинская лазурь KFe3+[Fe2+(CN)6]. Издревле использовалась как краситель для ткани.
- Гексацианоферрат (III) калия K3[Fe(CN)6]. Другое название — красная кровяная соль. Используется как качественный реагент на определение иона железа Fe2+. В результате образуется синий осадок, имеющий название турнбулева синь. Также использовалась, как краситель для ткани.