Соль
Содержание:
- Типы солей
- Вред и противопоказания
- Методы получения
- Методы получения
- Химические свойства
- Факты
- Розовая гималайская соль
- Изготовление пластилина
- Ароматические соли
- Физические свойства и строение солей
- Производство пищевой соли
- Красная соль
- Применение
- Как уменьшить потребление соли
- Как правильно принимать ванны с морской солью
- Памятка
- Как отличить подделку от настоящей гималайской соли
- Использование солевого мытья.
- Различия в технологиях производства технической, пищевой и кормовой соли
- Применение солей
- Типы солей
- Методы получения
Типы солей
Если рассматривать соли как продукты замены катионов в кислотах или гидроксогрупп в основаниях, то можно выделить следующие типы солей:
- Средние (нормальные) соли — продукты замещения всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4).
- Кислые соли — продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
- Осно́вные соли — продукты неполного замещения гидроксогрупп основания (OH-) кислотными остатками ((CuOH)2CO3). Они образуются в условиях избытка основания или недостатка кислоты.
- Комплексные соли (Na2)
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей:
- Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl)
- Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
- Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например, Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], [Cu(NH3)4](OH)2). Внутренние соли образованы биполярными ионами, то есть молекулами, содержащими как положительно заряженный, так и отрицательно заряженный атом.
Вред и противопоказания
Избыток соли наносит вред при заболеваниях печени, почек, сердца – поэтому врачи назначают диету с пониженным поступлением натрия.
Вред соли при варикозной болезни – в поддержании катионами натрия отеков, воспалительных процессов, набухания клеток сосудистой стенки, повышении давления внутри сосудов.
Соль вредна при отеках, причина которых – слабость сердечной деятельности при гипертонии, после инфаркта и перенесенного миокардита.
Избыток соли наносит вред при почечной недостаточности, гломерулонефрите, любых заболеваниях мочеполовых органов.
Ограничить потребление при гастрите и заболеваниях, которые требуют усиленной деятельности сердца и почек.
Методы получения
Существуют различные методы получения солей:
Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:
H2SO4+MgO⟶MgSO4+H2O{\displaystyle {\mathsf {H_{2}SO_{4}+MgO\longrightarrow MgSO_{4}+H_{2}O}}}
3H2SO4+Al2O3⟶Al2(SO4)3+3 H2O{\displaystyle {\mathsf {3H_{2}SO_{4}+Al_{2}O_{3}\longrightarrow Al_{2}(SO_{4})_{3}+3\ H_{2}O}}}
Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:
Ca(OH)2+CO2⟶CaCO3↓+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}\downarrow +H_{2}O}}}
CaO+SiO2⟶CaSiO3{\displaystyle {\mathsf {CaO+SiO_{2}\longrightarrow CaSiO_{3}}}}
Al2O3+3 SO3⟶Al2(SO4)3{\displaystyle {\mathsf {Al_{2}O_{3}+3\ SO_{3}\longrightarrow Al_{2}(SO_{4})_{3}}}}
Mg(OH)2+CO2⟶MgCO3↓+H2O{\displaystyle {\mathsf {Mg(OH)_{2}+CO_{2}\longrightarrow MgCO_{3}\downarrow +H_{2}O}}}
Zn(OH)2+SO3⟶ZnSO4+H2O{\displaystyle {\mathsf {Zn(OH)_{2}+SO_{3}\longrightarrow ZnSO_{4}+H_{2}O}}}
Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):
CuCl2+Na2S⟶2NaCl+CuS↓{\displaystyle {\mathsf {CuCl_{2}+Na_{2}S\longrightarrow 2NaCl+CuS\downarrow }}}
Взаимодействие простых веществ:
Fe+S⟶FeS{\displaystyle {\mathsf {Fe+S\longrightarrow FeS}}}
Взаимодействие оснований с неметаллами, например, с галогенами:
Ca(OH)2+Cl2⟶Ca(OCl)Cl+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+Cl_{2}\longrightarrow Ca(OCl)Cl+H_{2}O}}}
Кристаллогидраты обычно получают при кристаллизации соли из водных растворов, однако известны также кристаллосольваты солей, выпадающие из неводных растворителей (например, CaBr2·3 C2H5OH).
Методы получения
Существуют различные методы получения солей:
Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:
H2SO4+MgO⟶MgSO4+H2O{\displaystyle {\mathsf {H_{2}SO_{4}+MgO\longrightarrow MgSO_{4}+H_{2}O}}}
3H2SO4+Al2O3⟶Al2(SO4)3+3 H2O{\displaystyle {\mathsf {3H_{2}SO_{4}+Al_{2}O_{3}\longrightarrow Al_{2}(SO_{4})_{3}+3\ H_{2}O}}}
Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:
Ca(OH)2+CO2⟶CaCO3↓+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}\downarrow +H_{2}O}}}
CaO+SiO2⟶CaSiO3{\displaystyle {\mathsf {CaO+SiO_{2}\longrightarrow CaSiO_{3}}}}
Al2O3+3 SO3⟶Al2(SO4)3{\displaystyle {\mathsf {Al_{2}O_{3}+3\ SO_{3}\longrightarrow Al_{2}(SO_{4})_{3}}}}
Mg(OH)2+CO2⟶MgCO3↓+H2O{\displaystyle {\mathsf {Mg(OH)_{2}+CO_{2}\longrightarrow MgCO_{3}\downarrow +H_{2}O}}}
Zn(OH)2+SO3⟶ZnSO4+H2O{\displaystyle {\mathsf {Zn(OH)_{2}+SO_{3}\longrightarrow ZnSO_{4}+H_{2}O}}}
Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):
CuCl2+Na2S⟶2NaCl+CuS↓{\displaystyle {\mathsf {CuCl_{2}+Na_{2}S\longrightarrow 2NaCl+CuS\downarrow }}}
Взаимодействие простых веществ:
Fe+S⟶FeS{\displaystyle {\mathsf {Fe+S\longrightarrow FeS}}}
Взаимодействие оснований с неметаллами, например, с галогенами:
Ca(OH)2+Cl2⟶Ca(OCl)Cl+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+Cl_{2}\longrightarrow Ca(OCl)Cl+H_{2}O}}}
Кристаллогидраты обычно получают при кристаллизации соли из водных растворов, однако известны также кристаллосольваты солей, выпадающие из неводных растворителей (например, CaBr2·3 C2H5OH).
Химические свойства
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, малодиссоциирующие вещества, например, вода):
BaCl2+H2SO4⟶BaSO4↓+2HCl{\displaystyle {\mathsf {BaCl_{2}+H_{2}SO_{4}\longrightarrow BaSO_{4}\downarrow +2HCl}}}
Na2SiO3+2HCl⟶2NaCl+H2SiO3↓{\displaystyle {\mathsf {Na_{2}SiO_{3}+2HCl\longrightarrow 2NaCl+H_{2}SiO_{3}\downarrow }}}
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряду активности металлов:
Cu+HgCl2⟶CuCl2+Hg{\displaystyle {\mathsf {Cu+HgCl_{2}\longrightarrow CuCl_{2}+Hg}}}
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
CaCl2+Na2CO3⟶CaCO3↓+2NaCl{\displaystyle {\mathsf {CaCl_{2}+Na_{2}CO_{3}\longrightarrow CaCO_{3}\downarrow +2NaCl}}}
AgNO3+NaCl⟶AgCl↓+NaNO3{\displaystyle {\mathsf {AgNO_{3}+NaCl\longrightarrow AgCl\downarrow +NaNO_{3}}}}
K2Cr2O7+3Na2SO3+4H2SO4⟶Cr2(SO4)3+3Na2SO4+K2SO4+4H2O{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+3Na_{2}SO_{3}+4H_{2}SO_{4}\longrightarrow Cr_{2}(SO_{4})_{3}+3Na_{2}SO_{4}+K_{2}SO_{4}+4H_{2}O}}}
Некоторые соли разлагаются при нагревании:
Диссоциация в водных растворах
При растворении в воде соли полностью или частично диссоциируют на ионы. Если диссоциация происходит нацело, то соли являются сильными электролитами, иначе — слабыми. Примером типичных сильных электролитов могут служить соли щелочных металлов, которые в растворе существуют в виде сольватированных ионов. Несмотря на то, что широко распространена теория, утверждающая, что соли в водном растворе диссоциируют полностью, в реальности для большинства солей наблюдается частичная диссоциация, например, 0,1 M раствор FeCl3 содержит лишь 10 % катионов Fe3+, а также 42 % катионов FeCl2+, 40 % катионов FeCl2+, 6 % катионов FeOH2+ и 2 % катионов Fe(OH)2+.
Гидролиз солей
Некоторые соли в водном растворе способны подвергаться гидролизу. Данная реакция протекает обратимо для солей слабых кислот (Na2CO3) или слабых оснований (CuCl2), и необратимо — для солей слабых кислот и слабых оснований (Al2S3).
Факты
- Существует известная крылатая фраза «Пуд соли съесть». По вычислениям физиологов, современный человек потребляет в год около пяти килограммов соли, следовательно, пуд соли вдвоём можно съесть за полтора-два года; ранее это время ввиду дороговизны продукта было значительно больше.
- Весной 1648 года в Москве произошёл Соляной бунт, вызванный, в числе прочего, непомерно высоким налогом на соль. Тысячелетия назад соль была настолько дорога, что из-за неё устраивали войны.
- В соли, поступающей в продажу, содержание NaCl составляет от 97 % (второй сорт) до 99,7 % (экстра), остальная доля приходится на различные примеси (сульфат натрия, хлорид калия и др.), а также зачастую добавки. Чаще всего добавляют йодиды и карбонаты, а в последние годы фториды. Добавка фторидов используется для профилактики зубных заболеваний. С 1950-х годов добавлять фторид в соль стали в Швейцарии, и благодаря положительным результатам в борьбе с кариесом в 1980-х годах фторид стали добавлять в соль во Франции и в Германии.
- В поваренную соль добавляют другие вспомогательные вещества, например, ферроцианид калия (E536 в европейской системе кодирования пищевых добавок; неядовитая комплексная соль) в качестве антислёживающего агента.
- В США продаются различные продукты, рекламируемые как «соль с пониженным содержанием натрия» (англ. low sodium salt). Уменьшение содержания натрия достигается за счёт снижения количества поваренной соли на единицу объёма. Один из вариантов производства — частичное замещение хлорида натрия другими химическими соединениями, такими, как хлорид калия или магния. Другой вариант — изменение исходной кристаллической структуры соли («снежинки» вместо характерных призм), в результате чего её объёмная плотность уменьшается (0,76 г/см³ против 1,24 г/см³ у «обычной» соли), и одна ложка продукта содержит на треть меньше натрия (да и соли как таковой).
- Известно, что, уходя из таёжного приюта, охотники непременно оставляют спички и соль для случайных путников.
- На Руси среди православных было принято в Страстной четверг готовить так называемую «четверговую соль» — крупную соль смешивали с квасной гущей или мякишем ржаного хлеба и перекаливали на сковороде, после чего толкли в ступе. Четверговую соль употребляли с пасхальными яйцами и некоторыми другими блюдами.
- Гадание посредством соли именуется аломантия.
- В результате добычи соли в Луизиане образовался Луизианский провал.
- В геральдике соль изображена в гласных гербах российских городов Солигалича, Соликамска, Сольвычегодска, Энгельса, Усолье-Сибирское, а также украинских городов Бахмута и Дрогобыча.
Розовая гималайская соль
3. Гималайская розовая пищевая соль
Эта соль поступает на наши прилавки прямиком из древнего морского дна Гималайских гор. Розовый цвет обусловлен высоким содержанием железа.
Продукт действительно богат минералами и содержит все 84 основных микроэлемента, необходимых нашему телу.
Розовая соль –это настоящий кладезь здоровья и пользы. Этот продукт может помочь во многих процессах, протекающих в организме человека. Например, употребление розовой соли способствует уменьшению мышечных судорог, повышению сахара в крови и повышению здорового рН –баланса в ваших клетках.
Эксперты сходятся во мнении на том, что именно розовая гималайская соль является самой полезной, и рекомендуют её к частому потреблению в пищу как можно чаще. Кроме того, её популярность сделала эту соль более доступной, чем раньше.
Сегодня этот вид соли перестал был экзотикой, и любой желающий без труда может найти её на прилавках супермаркета своего родного города.
Изготовление пластилина
Все, что вам нужно сделать, это получить чашку муки, чашку воды, полчашки соли, две столовые ложки тартар-крема и две столовые ложки масла. Затем начните взбивать тартар, сливки, муку, масло и соль, медленно добавляя в смесь воду. Готовьте на среднем огне, часто помешивая, пока тесто не затвердеет. Как только это будет сделано, выложите тесто на вощеную бумагу и отложите его для охлаждения. Затем замесить тесто до желаемой консистенции.

Вы также можете отремонтировать стены с помощью соли. Что вы должны сделать, чтобы заполнить отверстия для ногтей и закрепить маленькие кубики и чипсы на штукатурке или стенах Sheetrock, это смешать две столовые ложки соли и две столовые ложки кукурузного крахмала, прежде чем добавить достаточно воды около пяти чайных ложек для приготовления пасты. Когда вы закончите, используйте эту пасту, чтобы заполнить эти отверстия.
Ароматические соли
Важную роль в нашей жизни играют минеральные соли. Виды, которые существуют сегодня, способны удивить каждого. Несмотря на то что они все достаточно схожи по вкусу, опытные повара не только различают их, но и отдают предпочтение наиболее экзотическим видам.
Одной из наиболее популярных считается гималайская. Она имеет розовый окрас. Ее залежи образовались около 250 миллионов лет назад. Уникальный цвет образовался вследствие взаимодействия соли и магмы. Такая специя чистая и натуральная. Благодаря плотной консистенции ее нередко используют в строительстве.Еще одна популярная ароматическая соль — сванская. Она образовалась благодаря соединению привычной для нас специи и пряностей. Можно как приготовить ее самостоятельно, так и приобрести готовый продукт.

Физические свойства и строение солей
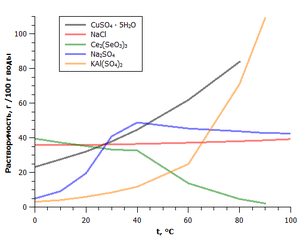
Зависимость растворимости некоторых солей от температуры
Как правило, соли представляют собой кристаллические вещества с ионной кристаллической решёткой. Например, кристаллы галогенидов щелочных и щёлочноземельных металлов (NaCl, CsCl, CaF2) построены из анионов, расположенных по принципу плотнейшей шаровой упаковки, и катионов, занимающих пустоты в этой упаковке. Ионные кристаллы солей могут быть построены также из кислотных остатков, объединённых в бесконечные анионные фрагменты и трёхмерные каркасы с катионами в полостях (силикаты). Подобное строение соответствующим образом отражается на их физических свойствах: они имеют высокие температуры плавления, в твёрдом состоянии являются диэлектриками.
Известны также соли молекулярного (ковалентного) строения (например, хлорид алюминия AlCl3). У многих солей характер химических связей является промежуточным между ионным и ковалентным.
Особый интерес представляют ионные жидкости — соли с температурой плавления ниже 100 °С. Кроме аномальной температуры плавления ионные жидкости имеют практически нулевое давление насыщенного пара и высокую вязкость. Особые свойства этих солей объясняются низкой симметрией катиона, слабым взаимодействием между ионами и хорошим распределением заряда катиона.
Важным свойством солей является их растворимость в воде. По данному критерию выделяют растворимые, мало растворимые и нерастворимые соли.
Производство пищевой соли
Способы добычи хлорида натрия практически не изменились с древних времен, причем производство вещества имеется практически в каждой стране. Назовем основные способы:
- Выпаривание в специальных резервуарах морской воды. В данном случае в составе обычно входит множество полезных элементов, в том числе йод.
- Добыча из недр земли в карьерах и шахтах – такое вещество почти не содержит влаги и примесей.
- Вымывание и выпаривание соляного раствора, таким образом производят соль сорта «Экстра», она отличается наивысшей степенью очистки.
- Собирание со дна соляных озер, так получают самосадочную соль, которая как и морская, содержит немало необходимых организмам минеральных элементов.
Красная соль
7. Красная гавайская соль
Еще один вид гавайской соли –красная. Она получает свой цвет от вулканической гавайской глины (alaea). Когда вода испаряется, эта соль попадает в приливные бассейны, где она и смешивается с этой самой глиной, цвет которой ярко-рыжий, почти красный.
По имеющимся оценкам специалистов, красная гавайская соль в своем составе содержит самую высокую концентрацию основных микроэлементов и особенно богата железом. Это делает соль чрезвычайно полезным для здоровья человека продуктом.
Поэтому если вашему организму не хватает железа, такая соль может стать отличной добавкой к вашей правильно сбалансированной диете.
Применение
Пищевой продукт
Кристаллы поваренной соли
Красная каменная соль из в Пакистане
В приготовлении пищи соль употребляется как важная приправа. Соль имеет хорошо знакомый каждому человеку характерный вкус, без которого пища кажется пресной. Такая особенность соли обусловлена физиологией человека, но люди зачастую потребляют соли больше, чем необходимо для физиологических процессов.
Соль обладает слабыми антисептическими свойствами; 10—15%-е содержание соли предотвращает развитие гнилостных бактерий, что служит причиной её широкого применения в качестве консерванта пищи и иных органических масс (кожи, древесины, клея).
Сейчас существует множество экзотических сортов соли (копчёная французская, чёрная, розовая перуанская, Гималайская каменная розовая — добывается вручную в горах Гималаи, в основном в Пакистане и пр.), в некоторых ресторанах (например, в таиландском курортном Пхукете) существует даже специальность «солевой сомелье».
Злоупотребление солью
По данным Всемирной организации здравоохранения, систематический приём избыточного по сравнению с физиологической нормой количества соли приводит к повышению кровяного давления и, как следствие, — к разнообразным болезням сердца и почек, раку желудка и остеопорозу. Наряду с другими солями натрия поваренная соль может стать причиной заболеваний глаз и отёка век — соль задерживает в организме воду, большой объём которой «хранит» в себе жировая ткань. Может привести к повышению внутриглазного давления и развитию катаракты.
Физиологической нормой для одного человека считается 5 граммов соли в день. В Европе и США, однако, средний житель потребляет около 10 граммов. Во многих странах Европы и штатах США развёрнуты программы по разъяснению губительных последствий злоупотребления солью. В Англии принят закон, требующий сообщать на этикетках пищевых продуктов о содержании в них соли.
В Финляндии удалось снизить потребление соли на треть, благодаря чему смертность от инсультов и инфарктов уменьшилась на 80 %.
Исследования, которые проводились в европейских странах, показали, что в период беременности женщина должна потреблять обычное количество соли. Злоупотребление солью может привести к ослаблению системы кровообращения, гипертонии, но и недостаток соли вреден. Сильное ограничение в соли может ухудшить отёки, плохо повлиять на развитие почек у будущего ребёнка, что может спровоцировать гипертонию в будущем.
Бессолевая диета
Бессолевая диета применяется только в лечебных целях и проводится под наблюдением специалиста. Она назначается при заболеваниях почек и мочевыводящих путей. В ходе диеты может происходить снижение веса за счёт потери воды как следствие уменьшения концентрации соли в организме.
Химическая промышленность
Поваренная соль используется в промышленности для получения соды, хлора, соляной кислоты, гидроксида натрия и металлического натрия.
Соль, будучи смешанной со льдом (в том числе в форме снега), вызывает его таяние (плавление). Образовавшийся водно-солевой раствор имеет температуру кристаллизации (замерзает) ниже 0 °C, которая зависит от количества соли в растворе (чем выше концентрация, тем ниже температура кристаллизации раствора). Это явление используется для очистки дорог от льда и снега.
Как уменьшить потребление соли
Во-первых, меньше солить, а также ограничить богатые натрием приправы, используемые во время приготовления пищи. Сюда относятся соевый соус, глутамат натрия, бульонные кубики;
Во-вторых, ограничить употребление солёных закусок, консервированных овощей;
В-третьих, недосаливать блюда и вообще не ставить на стол солёные соусы и солонку;
В-четвёртых, выбирать продукты с низким содержанием натрия. Для этого читайте состав, ищите информацию на этикетках. Сейчас производители указывают такие данные.
В-пятых, использовать заменители, где половина хлорида натрия заменена полезными солями калия и магния.
Сбалансировать избыток натрия в некоторой степени можно калием. Калий, напротив, снижает давление и уменьшает риски развития сердечно-сосудистых заболеваний.
Продукты, богатые калием:
- овощи;
- фрукты;
- бобовые;
- зерновые (гречка, овсянка, перловка и т. д.)
Как правильно принимать ванны с морской солью
Талассотерапию применял Гиппократ. Морские купания всегда назначались в комплексе терапии нервных и кожных заболеваний. Полезно совмещать действие морской соли и ультрафиолета. Продукт добавляют в частные открытые и закрытые бассейны для улучшения антибактерицидных свойств воды.
На ванну стандартных размеров добавляют до 200-300 г соли, сдабривают воду эфирными маслами (удобно использовать растворимые шарики). Детям концентрацию уменьшают вдвое.
Продолжительность процедуры 15–20 минут, рекомендуемая температура воды +38°С. Ванны принимают курсом по 7–10 дней, после чего делают перерыв на тот же срок, затем курс повторяют. После процедуры желательно лечь в постель на 30 минут, чтобы мышцы до конца расслабились.
Ванна Клеопатры – это приготовление соленого молочного раствора. На литр молока добавляют 2 ст. л. морской соли. На ванную стандартного объема потребуется до 3 л смеси. Кожа станет бархатистой, приятной на ощупь. Длительность процедуры до 30 минут, периодичность – 2 раза в неделю.
Памятка
- Отказывайтесь от соли постепенно. Для начала перестаньте солить салаты и овощи, а затем супы и вторые блюда. Вкусовые рецепторы вскоре перестроятся, и необходимость в этом отпадет сама собой.
- Если захотелось солененького, съешьте что-нибудь полезное — квашеную или морскую капусту, кусочек твердого сыра.
- Ограничьте потребление магазинных продуктов с избыточным содержанием соли. Замените консервы и полуфабрикаты натуральными мясом, рыбой и птицей.
- Чаще готовьте на пару, запекайте — это и полезно, и сохраняет в пище естественные микроэлементы.
- Поваренную соль желательно заменить на более полезную — морскую.
- Живя на малосолевой диете, вы всегда получите свою норму соли.
- Если врач прописал вам бессолевую диету, соблюдайте все предписания и не забывайте, что это временная мера (максимум до 2 недель).
- Помните, что плохо — это когда много или мало, и отлично — когда норма.
Как отличить подделку от настоящей гималайской соли
Чтобы не столкнуться с негативными последствиями, нужно соблюдать ряд правил при покупке продукта:
- изучить состав, в котором не должно быть эмульгаторов и добавок;
- приобрести пробный образец, растворить его в воде, оставить на сутки в темном помещении и проверить цвет раствора: если он прозрачный, то продукт оригинальный, когда жидкость окрасилась в розовый цвет, соль является подделкой;
- посмотреть страну, где изготовили продукцию (Непал, Пакистан или Индия).

При покупке гималайской соли, нужно остерегаться подделок.
Минералы, представленные на рынке, не всегда полезны. В некоторых случаях производитель смешивает белую пищевую соль с красителями или добавляет промышленные отходы. Такая продукция может навредить организму.
Использование солевого мытья.
У вас есть разливы вина на хлопчатобумажной льняной или льняной скатерти? Нет проблем, если вы использовали соль, чтобы навести порядок. Высушите пятно и покройте винное пятно кучкой соли, которая удаляет вино из волокна. А чтобы лучше удалить пятна от вина на хлопчатобумажной льняной или льняной скатерти, замочите ее в холодной воде примерно на тридцать минут, прежде чем стирать.
Другое использование соли для стирки — чрезмерное подавление. Вы можете удалить лишнюю пену щепоткой соли во время стирки. Вы также можете использовать его для сушки одежды зимой, если вы используете его при последнем полоскании, чтобы предотвратить замерзание одежды при вывешивании ее на улице.
Это может также украсить цвета одежды и ткани, особенно цветные шторы или волокнистые ковры. Все, что вам нужно сделать, это сделать раствор с соленой водой, который может осветить вашу тень Если у вас есть обесцвеченные ковры и коврики, вы также можете осветлить их цвет, энергично потерев их чистой тканью, смоченной в растворе соленой воды, прежде чем снимать их.
И если вы хотите избавиться от пятен пота, вы также можете сделать это с солью, просто добавив четыре столовые ложки супа в литр теплой воды. Окуните губку в раствор и протрите ею ткань, пока пятно не исчезнет.

Говоря о пятнах, вы также можете использовать соль, избавившись от пятен крови на одежде. Все, что вам нужно сделать, это замочить испачканную ткань в холодной соленой воде, прежде чем стирать ее в теплой мыльной воде. Кипятите одежду после стирки, но используйте этот раствор только на постельных принадлежностях, хлопке и других видах натуральных волокон, которые могут противостоять теплу.
Теперь, чтобы обработать пятна ржавчины и плесень, вы можете смочить пятна на поверхности смесью соли и лимонного сока. Затем вам придется распределить окрашенный продукт под солнцем, чтобы отбелить его перед полосканием и сушкой.
Мало того, что соль идеально подходит для многих растворов для стирки, но и против грязного железного пола. Все, что вам нужно сделать, это посыпать щепотку соли на лист бумаги, прежде чем ставить на него горячий утюг, чтобы избавиться от липких железных пятен.
И чтобы установить цвет, вы также можете использовать соль, которая также используется в текстильной промышленности. Он также может работать для дома, особенно в одежде, которая не очень устойчива. Что вам нужно сделать, это замочить одежду в течение одного часа в половине галлона воды, где вы добавили полчашки соли и полстакана уксуса перед полосканием. Если вы найдете цвет в воде, повторите тот же процесс. Это решение идеально подходит только для ткани или ткани одного цвета. Для различных цветов решение — химическая чистка, чтобы препятствовать тому, чтобы цвета смешались вместе.
Различия в технологиях производства технической, пищевой и кормовой соли
Получение технической соли
Такую соль доставляют с месторождения, очищают от твердых галитовых отходов на металлоулавливателе, дробят до получения нужного размера. При необходимости продукцию обрабатывают антислеживателем.
Производство пищевой соли
Состоит из следующих этапов:
- Очистка. Галит проходит несколько моек, затем его дробят и специальным сепаратором извлекают ненужные металлические примеси.
- Сушка производится при помощи промышленной центрифуги.
- Дробление. Соль отправляют на вибрационный транспортер, где гранулы приобретают нужный размер.
- Окончательное высушивание производится в печи, где горячий воздух нагнетается промышленным вентилятором.
Процесс производства кормовой соли
Соль-лизунец изготавливают из чистой самосадочной соли на специальных станках. Кристаллический хлористый натрий засыпают в лотки, где под давлением они превращаются в брикет, по плотности похожий на камень. Еще один вариант для изготовления брикетов – использовать вибростол.
Производство таблетированной соли
Для изготовления таблеток используется сырье высокой степени очистки. Содержание натрий хлора достигает 99,7%. Продукт получают путем выпаривания на специальном оборудовании, дозирования и прессования в таблетки.
Применение солей
Соли повсеместно используются как в производстве, так и в повседневной жизни.
- Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.Хлорид калия используют в сельском хозяйстве как калийное удобрение.
- Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.
- Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
- Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов — фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений, например, суперфосфата и преципитата.
- Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Типы солей
Если рассматривать соли как продукты замены катионов в кислотах или гидроксогрупп в основаниях, то можно выделить следующие типы солей:
- Средние (нормальные) соли — продукты замещения всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4).
- Кислые соли — продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
- Осно́вные соли — продукты неполного замещения гидроксогрупп основания (OH-) кислотными остатками ((CuOH)2CO3). Они образуются в условиях избытка основания или недостатка кислоты.
- Комплексные соли (Na2)
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей:
- Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl)
- Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
- Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например, Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], [Cu(NH3)4](OH)2). Внутренние соли образованы биполярными ионами, то есть молекулами, содержащими как положительно заряженный, так и отрицательно заряженный атом.
Методы получения
Существуют различные методы получения солей:
Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:
H2SO4+MgO⟶MgSO4+H2O{\displaystyle {\mathsf {H_{2}SO_{4}+MgO\longrightarrow MgSO_{4}+H_{2}O}}}
3H2SO4+Al2O3⟶Al2(SO4)3+3 H2O{\displaystyle {\mathsf {3H_{2}SO_{4}+Al_{2}O_{3}\longrightarrow Al_{2}(SO_{4})_{3}+3\ H_{2}O}}}
Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:
Ca(OH)2+CO2⟶CaCO3↓+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}\downarrow +H_{2}O}}}
CaO+SiO2⟶CaSiO3{\displaystyle {\mathsf {CaO+SiO_{2}\longrightarrow CaSiO_{3}}}}
Al2O3+3 SO3⟶Al2(SO4)3{\displaystyle {\mathsf {Al_{2}O_{3}+3\ SO_{3}\longrightarrow Al_{2}(SO_{4})_{3}}}}
Mg(OH)2+CO2⟶MgCO3↓+H2O{\displaystyle {\mathsf {Mg(OH)_{2}+CO_{2}\longrightarrow MgCO_{3}\downarrow +H_{2}O}}}
Zn(OH)2+SO3⟶ZnSO4+H2O{\displaystyle {\mathsf {Zn(OH)_{2}+SO_{3}\longrightarrow ZnSO_{4}+H_{2}O}}}
Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):
CuCl2+Na2S⟶2NaCl+CuS↓{\displaystyle {\mathsf {CuCl_{2}+Na_{2}S\longrightarrow 2NaCl+CuS\downarrow }}}
Взаимодействие простых веществ:
Fe+S⟶FeS{\displaystyle {\mathsf {Fe+S\longrightarrow FeS}}}
Взаимодействие оснований с неметаллами, например, с галогенами:
Ca(OH)2+Cl2⟶Ca(OCl)Cl+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+Cl_{2}\longrightarrow Ca(OCl)Cl+H_{2}O}}}
Кристаллогидраты обычно получают при кристаллизации соли из водных растворов, однако известны также кристаллосольваты солей, выпадающие из неводных растворителей (например, CaBr2·3 C2H5OH).