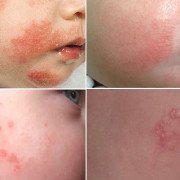
Острый миелобластный лейкоз
Содержание:
- Причины хронического миелолейкоза
- Виды миелоцитов
- Способы лечения
- Симптомы Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
- Лечение
- Диагностика Хронического миелоидного лейкоза:
- Проявления хронического миелолейкоза
- Оценка состояния костного мозга
- Лечение народными средствами
- Выживаемость
- Этиология заболевания
- Клинические проявления заболевания
- Симптомы
- Лечение и прогноз
- Терапия индукции
Причины хронического миелолейкоза
Считается, что имеют значение следующие факторы:
- Слабые дозы радиации. Их роль доказана только у 5% больных.
- Электромагнитные излучения, вирусы и некоторые химические вещества – их влияние не доказано окончательно.
- Применение некоторых лекарственных препаратов. Известны случаи возникновения хронического миелолейкоза при лечении цитостатиками (противоопухолевые препараты) в сочетании с лучевой терапией.
- Наследственные причины. Люди с хромосомными нарушениями (синдром Клайнфелтера, синдром Дауна) имеют повышенный риск хронического миелоидного лейкоза.
- Клетки размножаются неконтролируемо, как раковые.
- Для этих клеток перестают работать естественные механизмы гибели.
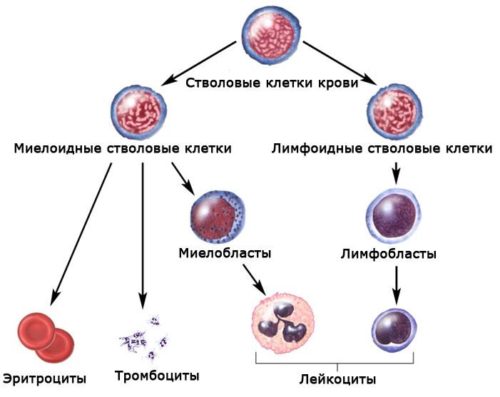
Виды миелоцитов

Миелоцит в мазке периферической крови
Миелоцитами называются клетки-предшественницы зрелых гранулоцитов — одной из разновидностей лейкоцитов.
Образование миелоцитов — это промежуточный этап гранулоцитопоэза, который начинается с митотического деления стволовой клетки.
Для того, чтобы полностью было понятно, что такое миелоциты и какое место они занимают в гемопоэзе, необходимо указать все формы клеток гранулоцитарного ростка кроветворения:
- Миелобласты — это клетки, которые появляются вследствие деления колониеобразующей стволовой клетки. Миелобласты утрачивают полипотентность — способность дифференцироваться в любые другие виды клеток. Основная их задача — обеспечение нормального созревания гранулоцитов.
- Промиелоциты — самые большие по размеру клетки во всех стадиях образования гранулоцитов. Уже на этом этапе созревания в клетках появляются первичные гранулы, которые делят промиелоциты на эозинофильные, базофильные и нейтрофильные.
- Миелоциты — образуются после третьего деления промиелоцитов. На такой стадии созревания зернистость клеток (включения) становится строго специфичной (вторичной), что позволяет уже четко разделять будущие нейтрофилы, базофилы и эозинофилы. Миелоциты — активно делящиеся клетки. От полноценности созревания миелоцитов зависит физиологическая активность и функциональность гранулоцитов.
- Метамиелоциты (юные лейкоциты) — такие клетки обладают низкой способностью к делению. Благодаря им происходит завершающий этап созревания гранулоцитов. Ядро метамиелоцитов претерпевает изменения, деля клетки на две большие группы — сегментоядерные и палочкоядерные.
- Гранулоциты — итог гранулоцитопоэза. Такие клетки называются полиморфно-ядерными, так как от их зернистости зависит тип клеток.
Таким образом, миелоциты — это клетки, которые определяют полноценный рост зрелых гранулоцитов. Относятся к зернистым лейкоцитам и дифференцируются в три основных вида белых клеток крови:
- нейтрофилы,
- эозинофилы,
- базофилы.
Способы лечения
Процесс лечения ОМЛ строго установлен медиками. Он включает в себя основной терапевтический блок и мероприятия, направленные против рецидивов. На первом этапе терапии назначают сильные цитостатики. Это химиотерапевтические препараты. их действие направлено на ликвидацию недозрелых бластов. В зависимости от течения болезни назначают несколько блоков “химии”.
Противорецидивная терапия включает три блока. Она направлена на восстановление нормального кроветворения. В её состав входят цитостатики и гормоны. Если у больного наступает стойкая ремиссия, ему проводят пересадку стволовых клеток костного мозга от донора. Зрелые здоровые клетки, поступая в больной организм, борются против незрелых клеточных форм. Они помогают обеспечивать полноценное кроветворение. При хорошей приживаемости состояние больного улучшается.
Симптомы Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
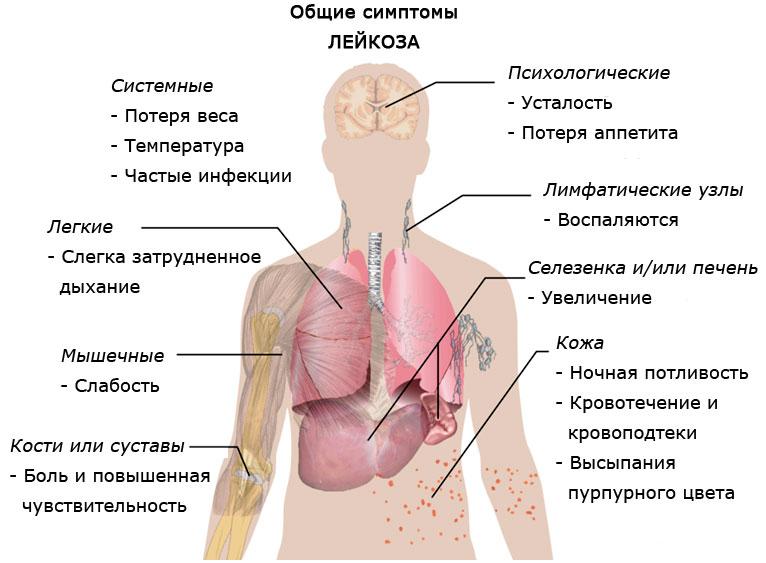
Клиническая картина ОМЛ достаточно хорошо известна и проявляется следующими синдромами: анемическим, геморрагическим и токсическим, которые характеризуются бледностью кожных покровов, выраженной слабостью, головокружением, снижением аппетита, повышенной утомляемостью, лихорадкой без проявлений катаральных явлений.
Лимфатические узлы у большинства больных — небольших размеров, безболезненные, не спаяны с кожей и друг с другом. В редких случаях наблюдаются увеличенные лимфатические узлы размером от 2,5 до 5 см с образованием конгломератов в шейно-надключичной области. Изменения в костно-суставной системе в некоторых случаях проявляются выраженными оссалгиями в нижних конечностях и в области позвоночного столба, что сопровождается нарушением движений и походки. На рентгенограммах костной системы отмечаются деструктивные изменения различной локализации, периостальные реакции, явления остеопороза. У большинства детей наблюдается небольшое увеличение печени и селезенки (выступают из-под края реберной дуги на 2-3 см).
Экстрамедуллярные опухолевые поражения чаще проявляются гингивитом и экзофтальмом, в том числе двусторонним; в редких случаях бывают опухолевая инфильтрация мягких тканей, гипертрофия нёбных миндалин, поражение носоглотки и лицевого нерва, а также лейкемиды на коже.
Экстрамедуллярные локализации ОМЛ объединяет термин «гранулоцитарная (миелобластная) саркома», включающая классическую хлорому и непигментированные опухоли.
По данным аутопсии, гранулоцитарная (миелобластная) саркома диагностируется в 3-8% случаев у больных ОМЛ. Она может предшествовать или сочетаться с признаками ОМЛ, характеризующимися бластной инфильтрацией костного мозга и наличием бластов в периферической крови, а также наблюдаться при рецидиве заболевания. Наиболее частой локализацией опухолевого роста является орбита (поражаются орбитальная ткань и внутренние структуры черепа). Бластные клетки чаще представлены М2-типом, имеющими транслокацию t(8;21). Ряд авторов указывают на более плохой прогноз у этих больных, чем при типичном ОМЛ.
Факторы прогноза у больных ОМЛ менее изучены, чем у больных с ОЛЛ. Было проведено большое количество одно- и многофакторных исследований, с помощью которых появилась возможность определения благоприятных и неблагоприятных признаков заболевания для назначения рационального лечения. Факторы, от которых зависит прогноз ОМЛ у детей, разделяют на клинические и лабораторные. К клиническим можно отнести возраст, пол, анамнез, размеры паренхиматозных органов, выраженность геморрагического синдрома, инициальное поражение ЦНС, время наступления ремиссии, количество курсов химиотерапии. Среди лабораторных прогностических факторов выделяют чувствительность бластных клеток к химиопрепаратам in vitro, количество лейкоцитов в анализе периферической крови, FAB-вариант ОМЛ, уровень фибриногена, уровень лактатдегидрогеназы, наличие палочек Ауэра в бластах.
Прогноз при ОМЛ зависит от FAB-морфологического варианта, данных генетического исследования и иммунофенотипа бластных клеток. Так, наиболее благоприятную группу составляют больные с морфологическими вариантами М1, М2 и t(8;21), t(9;11), М3 и t(15;17) или М4 и inv(16). В неблагоприятную для прогноза группу входят больные с вариантами М4 без inv(16), М5, М6 и М7, а также пациенты, при исследовании кариотипа опухолевых клеток которых были выявлены следующие хромосомные аномалии: t(9;22), t(6;11), t(10;11), del5q-, del7q-, моносомии -5, -7. Кроме того, нашими исследованиями удалось доказать, что на прогноз ОМЛ неблагоприятно влияет экспрессия эритроитных и В-линейных антигенов на поверхности бластов.
Лечение
Лечение ОМЛ небыстрое, зависящее от многих факторов. Лечение проводится исключительно под наблюдением врачей. Больного содержат в антисептических условиях, ограничивается общение. Протоколами МКБ строго регламентируются этапы, методы лечения. Терапия состоит из 2 этапов: индукция и консолидация. Первый этап — основной в борьбе с болезнью. Его целью является достижение устойчивой ремиссии, после достижения которой, врачи переходят ко второму этапу. Второй этап не менее важен, чем первый. Цель его – уничтожение остаточных вредоносных клеток. При невыполнении этапа консолидации, высока вероятность рецидива заболевания.
- Индукционная терапия. Основная задача данной терапии – восстановление здорового кроветворения путем разрушения бластных клеток. Для чего предусмотрены два курса химиотерапии. Применяются так называемые цитостатики: цитозин-арабинозид, этопозид, даунорубицин, тиогуанин. Применяются и лекарства нового поколения, эффективность которых изучается.
- Противорецидивное лечение или консолидационный этап. После успешной индукционной терапии с большой вероятностью возможны рецидивы. Поэтому необходимо пройти курс поддерживающей терапии, состоящий из 3 пунктов: поддерживающая химиотерапия, гормональная терапия глюкокортикоидами, трансплантация клеток красного костного мозга. Эти процедуры восстановят гемопоэз.
- Трансплантация костного мозга. Существует два вида пересадки. Первый называется аллогенный. Суть его в обеспечении реакции против злокачественных клеток, достигаемую имплантированием здоровых чужеродных клеток. Эти клетки до имплантации проходят через специальную химическую обработку. Второй – это аутогенный. К данному виду трансплантации прибегают лишь если достигнута полная ремиссия болезни.
После всех лечебных процедур и их удачном исходе, пациент еще в течение пяти лет находится под наблюдением специалистов. Если болезнь вновь вернулась, прибегают к более сильным схемам лечения.
Хотите получить смету на лечение?
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную смету на лечение.
Диагностика Хронического миелоидного лейкоза:
Картина крови и костного мозга В типичном случае характерен нейтрофильный лейкоцитоз с появлением молодых форм нейтрофилов, сопровождающийся гипертромбоцитозом, лимфоцитопенией. По мере развития болезни нарастают анемия и тромбоцитопения. У детей чаще наблюдается ювенильная форма хронического миелолейкоза без гипертромбоцитоза, но с высоким моноцитозом. Часто увеличивается число базофилов, имеет место эозинофилия. В первую доброкачественную стадию клетки костного мозга по всем параметрам соответствуют норме. Во вторую стадию в костном мозге и крови появляются бластные формы, отмечается быстрый рост числа лейкоцитов в крови (до нескольких миллионов в 1 мкл). Характерными признаками терминальной стадии является обнаружение в крови осколков ядер мегакариоцитов, угнетение нормального кроветворения.
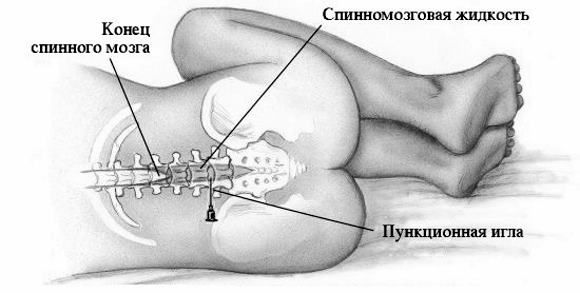
Диагноз хронического лейкоза устанавливается на основании жалоб, осмотра, анализов крови, биопсии, цитогенетического анализа. Помогают в установлении диагноза и такие вспомогательные методы обследования, как ПЭТ-КТ, КТ, МРТ.
Диагноз ставится по картине крови. Решающее значение имеет пункция костного мозга. Дифференциальный диагноз проводят с лимфогранулематозом и лимфосаркоматозом.
Проявления хронического миелолейкоза
Симптомы хронической фазы:
- Вначале симптомы могут полностью отсутствовать, либо они выражены настолько слабо, что больной не придает им особого значения, списывает на постоянное переутомление. Заболевание выявляется случайно, во время очередной сдачи общего анализа крови.
- Нарушение общего состояния: слабость и недомогание, постепенная потеря веса, снижение аппетита, повышенная потливость по ночам.
- Признаки, обусловленные увеличением размеров селезенки: во время приема пищи больной быстро наедается, боли в левой части живота, наличие опухолевидного образования, которое можно прощупать.
Более редкие симптомы хронической фазы миелолейкоза
- Признаки, связанные с нарушением функции тромбоцитов и белых кровяных телец: различные кровотечения либо, напротив, образование тромбов.
- Признаки, связанные с повышением количества тромбоцитов и, как следствие, повышением свертываемости крови: нарушение кровообращения в головном мозге (головные боли, головокружения, снижение памяти, внимания и пр.), инфаркт миокарда, нарушение зрения, одышка.
Симптомы терминальной стадии хронического миелолейкоза:
- Резкая слабость, значительное ухудшение общего самочувствия.
- Длительные ноющие боли в суставах и костях. Иногда они могут быть очень сильными. Это связано с разрастанием злокачественной ткани в красном костном мозге.
- Проливные поты.
- Периодическое беспричинное повышение температуры до 38 — 39⁰C, во время которого возникает сильный озноб.
- Снижение массы тела.
- Повышенная кровоточивость, появление кровоизлияний под кожей. Эти симптомы возникают в результате уменьшения количества тромбоцитов и снижением свертываемости крови.
- Быстрое увеличение размеров селезенки: живот увеличивается в размерах, появляется чувство тяжести, боли. Это происходит за счет роста опухолевой ткани в селезенке.
Оценка состояния костного мозга
Очевидно, что слово «норма» может применяться только по отношению к костному мозгу, ибо миелоциты в крови априори присутствовать не могут. И повышены они там только в силу определенных причин, а не просто так. Поэтому далее – о месте миелоцитов в костном мозге.

В настоящее время биопсия костного мозга и его исследование (цитологический анализ) является обязательной процедурой при подозрении на развитие гематологической патологии. Морфологические характеристики костного мозга после тестирования сопоставляют с показателями периферической крови.
Следует заметить, что при исследовании костного мозга (миелограмма) врачи обе генерации миелоцитов рассматривают вместе, не разделяя их на дочерние и материнские, поскольку подобное разделение не имеет абсолютно никакого значения ни для нормы, ни для патологии.
Таблица: клеточный состав костного мозга в норме (белый росток кроветворения)
| Элементы костного мозга | Границы нормальных значений,% | Средние значения,% |
|---|---|---|
| Ретикулярные клетки (клетки ретикулярной стромы) | 0,1 – 1,6 | 0,9 |
| Бласты | 0,1 – 1,1 | 0,6 |
| Миелобласты | 0,2 – 1,7 | 1,0 |
| Нейтрофилы: — промиелоциты — миелоциты — метамиелоциты — палочкоядерные — сегментоядерные | 1,0 – 4,1 7,0 – 12,2 8,0 – 15,0 12,8 – 23,7 13,1 – 24,1 | 2,5 9,6 11,5 18,2 18,6 |
| Все нейтрофильные элементы | 52,7 – 68, 9 | 60,8 |
| Индекс созревания нейтрофилов | 0,5 – 0,9 | — |
| Эозинофилы (все генерации) | 0,5 – 5,8 | 3,2 |
| Базофилы | 0 – 0,5 | 0,2 |
| Лимфоциты | 4,3 – 13,7 | 9,0 |
| Моноциты | 0,7 – 3,1 | 1,9 |
| Плазматические клетки | 0,1 – 1,8 | 0,9 |
Базофильные и эозинофильные миелобласты в здоровом костном мозге, как правило, не определяются (их трудно распознать), зато становятся довольно заметными при высокой эозинофильной реакции или хроническом миелолейкозе. Примерно то же самое происходит и с промиелоцитами – больше всех себя проявляют молодые клетки, которые стремятся стать нейтрофилами.
Что касается миелоцитов (эозинофильных, базофильных и нейтрофильных), то здесь ситуация несколько меняется, если к главному органу кроветворения нет претензий. Эозинофильный миелоцит, хотя ядром и похож на нейтрофильный, но отличается густой, заполняющей всю цитоплазму, зернистостью, базофильный миелоцит тоже легко распознается, он первым приобретает специфическую зернистость, которая негусто покрывает цитоплазму. При зарождении патологического процесса в костном мозге представители 3 генераций миелоцитов трудно различимы между собой и все напоминают нейтрофилы.
На стадии метамиелоцита, клетки уже «определились» в своей «профессии», поэтому специалисту, знающему их особенности и основные черты, нетрудно понять «кто есть кто». Между тем, описание ядра, цитоплазмы и других характеристик вряд ли заинтересует читателя, во всем этом трудно разобраться, тем более, если рядом нет микроскопа и клетку нельзя увидеть воочию. Поэтому не стоит попусту тратить время, более полезно будет рассказать о тех ситуациях, которые действительно могут волновать человека, например, о появлении миелоцитов у ребенка или их присутствии при беременности у женщины.
Лечение народными средствами
Так как хронический миелолейкоз – это грозное заболевание, и от правильности и своевременности его лечения зависит успех терапии, применять какие-либо народные методы лечения не следует. Их использование, особенно если речь идет о замене народными методами традиционного лечения, может привести в итоге к печальным последствиям.
С разрешения лечащего врача пациент может применять общеукрепляющие средства – например, травяные чаи (мелисса, мята, ромашка, малина, калина, боярышник, шиповник) с медом. Также можно готовить укрепляющие средства на основе меда, сухофруктов, орехов.
Выживаемость
При диагностировании монобластного лейкоза для его лечения необходимо обратиться к онкологу и гематологу.
По теме
Онкогематология
Зуд при лимфоме
- Ольга Владимировна Хазова
- 16 октября 2020 г.
Для получения прогностических данных важно принимать во внимание несколько основополагающих показателей:
- возрастная категория, к которой относится больной;
- стадия развития онкологического процесса;
- степень вовлеченности в заболевание других анатомических структур;
- время, когда именно была обнаружен болезнь;
- эффективность проводимого лечения.
На продолжительность жизни пациента будет влиять уровень поражения костного мозга и переносимость терапевтических процедур.
Если заболевание находится на острой стадии, то средняя выживаемость составляет примерно от одного до трех месяцев.
Если больной хорошо переносит лечение, и его состояние не ухудшается, то данные показатели могут составлять до трех лет жизни.
Этиология заболевания
Острый процесс развивается на фоне возникновения опухолевого клона, получившегося из-за сложных мутаций в костном мозге. Нормальная клетка не дозревает и выпускается в кровоток неполноценной. Начинается деление и распространение бластов, которые поражают костный мозг и другие органы человека. Происходит лейкемическая инфильтрация.
Точные причины, почему происходит мутация, неизвестны. Гематологи отмечают взаимосвязь вспышки заболевания с определёнными факторами:
- Основная предполагаемая причина развития рака крови – результат генетических мутаций в эмбриональном периоде. Дети с врождёнными синдромами наиболее подвержены развитию острого лейкоза.
- Наследственная предрасположенность провоцирует онкологический процесс у человека, чьи кровные родственники страдали от лейкемии.
- Радиационное облучение может поражать кроветворные органы, нарушать их функции и изменять вид кровяных телец.
- Профессиональные издержки, при которых человек вынужден контактировать с тяжёлыми химическими элементами.
- Лечение других онкологических болезней химиопрепаратами и ионизирующим излучением вызывает данное заболевание.
- Лейкоз может возникать на фоне тяжёлых вирусных патологий, которые угнетают иммунитет.
 Поражённые раком лейкоциты под микроскопом
Поражённые раком лейкоциты под микроскопом
Клинические проявления заболевания
При развитии ОМЛ наблюдают ряд синдромов:
- гиперпластический;
- геморрагический;
- анемический;
- интоксикацию и нейролейкоз;
- лейкостазы.
Они проявляются в виде типичной симптоматики, свидетельствующей о системном поражении всего организма. Для общей картины заболевания характерны постоянная усталость, плохой аппетит, бледность кожных покровов. Могут быть спонтанные скачки температуры, которые вначале принимают за проявления обычной простуды. В начале болезни увеличения лимфоузлов не наблюдают. Иногда возникают болезненные ощущения в ногах при ходьбе, которые поначалу проходят. Острый миелоидный лейкоз развивается постепенно, поэтому его симптомы появляются не сразу. Распознать заболевание в начальной стадии можно на основании развёрнутого анализа крови. Далеко не все пациенты подозревают у себя опасную болезнь, а тревожные симптомы часто списывают на усталость и переутомление.
На поздних стадиях ОМЛ возникают тяжёлая форма интоксикации, лейкостазы и нейролейкоз.
Гиперпластический синдром
Когда недозрелые клетки с током крови разносятся по организму, в органах человека возникает инфильтрация тканей. У больного появляются следующие признаки:
- увеличение периферических лимфоузлов, нёбных миндалин;
- увеличение селезёнки (спленомегалия);
- ощущение тяжести в области печени и её увеличение;
- отёчность верхних и нижних конечностей, лица;
- боли в мышцах, костях и суставах.
Отёки появляются вследствие разрастания средостенных лимфатических узлов. Увеличенные лимфоузлы сдавливают область верхней полой вены, и происходит нарушение кровообращения. Шея отекает, лицо приобретает синеватый оттенок, больному трудно дышать. В тяжёлых случаях возникает стоматит Венсана. Его симптомы: отёчность дёсен, боль, трудности при приёме пищи.
Геморрагический синдром
Незрелые миелобласты мешают выработке других кровяных клеток – в том числе и тромбоцитов. В результате этого возникает геморрагический синдром. Он выражается в типичных симптомах:
- истончение сосудистых стенок;
- кровотечения из носа и под кожей, образование множественных гематом на теле;
- кровь идёт долго, её трудно остановить;
- постоянно кровоточат дёсна.
Гематомы на теле появляются даже при незначительном надавливании на кожу. При геморрагическом синдроме высок риск кровоизлияния в мозг.

Анемический синдром
Для анемического синдрома характерны:
- сильная слабость;
- бледность кожных покровов;
- апатичное состояние;
- беспричинные головные боли;
- обмороки;
- головокружения;
- сердечные боли;
- желание есть мел.
Анемические проявления коварны тем, что их легче всего принять за обычное недомогание. Выпадение волос и ломкость ногтей больные часто принимают за недостаток витаминов. Если такое состояние не прекращается, нужно пройти обследование, чтобы заранее исключить злокачественную патологию крови.
Интоксикация и нейролейкоз
При интоксикации возникают:
- быстрая потеря веса;
- снижение аппетита;
- проливной пот;
- высокая температура (37-40С);
- тошнота и рвота;
- понос.
Вследствие снижения иммунитета на поздней стадии ОМЛ присоединяются бронхиты, воспаления лёгких и тяжёлые грибковые поражения слизистых.
Нейролейкозом называют комплекс симптомов, которые возникают при поражении мозга. Пациента мучают сильные головные боли, тошнота и рвота. Могут возникнуть приступы, похожие на эпилептические. При обследовании выявляют стойкое повышение внутричерепного давления. У больного ухудшается слух, нарушается речь, падает острота зрения. При системном поражении мозговых отделов возникают сумеречные состояния и нарушения восприятия окружающего мира.
Лейкостазы
Если при остром миелобластном лейкозе наблюдают общее замедление кровотока (или лейкостаз), прогноз жизни неутешителен. Число незрелых клеток в крови составляет 100 000 1/мкл и больше. Кровь становится густой и вязкой, происходит застой кровообращения во всех органах. Поскольку сосуды больного истончены, риск геморрагического инсульта становится во много раз выше. При лейкостазах высока частота летальных исходов.
Если лейкостаз возникает в малом кругу кровообращения, это чревато не только проблемами с дыханием, но и двусторонней пневмонией. Лечить её непросто, поскольку иммунная система больного подавлена, а содержание кислорода в крови падает с каждым днём. Все инфекционные заболевания, которые присоединяются на поздней стадии ОМЛ, протекают тяжело, с осложнениями, опасными для жизни.
Симптомы
Преобладающие симптомы, проявляющиеся при миелолейкозе, определяются стадией (степенью тяжести) заболевания.
Проявления на начальной стадии
Доброкачественный миелоидный лейкоз на начальной стадии не сопровождается выраженной симптоматикой и нередко обнаруживается случайно, в ходе сопутствующего диагностирования.
Симптомы акселеративной стадии
Акселеративная стадия проявляется:
- Потерей аппетита.
- Похудением.
- Повышенной температурой.
- Упадком сил.
- Одышкой.
- Учащёнными кровотечениями.
- Побледнением кожи.
- Гематомами.
- Обострениями воспалительных заболеваний носоглотки.
- Нагноениями повреждений кожных покровов (царапин, ран).
- Болезненными ощущениями в ногах, позвоночнике.
- Вынужденной ограниченностью двигательной активности, изменениями походки.
- Увеличением небных миндалин.
- Припухлостью десен.
- Повышением числа лейкоцитов, концентрации мочевой кислоты в крови.

Симптомы терминальной стадии
Для терминальной стадии миелолейкоза характерно стремительное развитие симптоматики, ухудшение самочувствия, развитие необратимых патологических процессов.
Симптоматика миелолейкоза дополняется:
- Многочисленными кровоизлияниями.
- Интенсификацией потоотделения.
- Стремительной потерей веса.
- Ноющими костными, суставными болями различной интенсивности.
- Повышением температуры до 38-39 градусов.
- Ознобом.
- Увеличением селезёнки, печени.
- Частыми обострениями инфекционных недугов.
- Анемией, снижением концентрации тромбоцитов, появлением миелоцитов, миелобластов в крови.
- Формированием некротических зон на слизистых оболочках.
- Увеличением лимфоузлов.
- Сбоями в функционировании зрительной системы.
- Головными болями.
Терминальная стадия миелолейкоза сопровождается бластным кризом, повышенным риском смертельного исхода.
Особенности течения хронического миелолейкоза
Хроническая стадия имеет наибольшую продолжительность (в среднем – около 3-4 лет) среди всех стадий недуга. Клиническая картина миелолейкоза преимущественно размыта и не вызывает опасений у пациента. С течением времени заболевания симптомы усугубляются, совпадая с проявлениями острой формы.
Ключевая особенность хронического миелоидного лейкоза заключается в более низкой скорости развития симптоматики и осложнений по сравнению со стремительно прогрессирующей острой формой.
Лечение и прогноз
ОМЛ – возрастное заболевание. У детей оно встречается редко. Основной риск заболеть первичным лейкозом отмечается после 65 лет. Прогноз у молодых пациентов – лучше, так как они способны перенести максимально агрессивное лечение и более высокие дозы химиотерапии.
В целом при своевременном обращении к специалистам прогноз оптимистичный для большинства типов. Но определить это можно только после проведения анализов. Все подвиды миелоидного лейкоза индивидуально реагируют на лечение. В общих словах можно сказать, что терапия длится около 1,5 лет. Многое зависит от количества больных клеток и от того, насколько они проникли в другие органы. Также важный показатель – возраст больного. Но только правильно продиагностированный тип болезни и исследование самих хромосом позволят определить вероятность рецидива и продолжительность ремиссии.

2 этапа лечения ОМЛ
Непосредственно сама химиотерапия, её ещё называют индукция. Она проводится в условиях стационара. Препараты, которые используются при её проведении, называются цитостатическими. Например, «Цитарабин» – лекарство из группы антиметаболитов. Суть химиотерапии заключается в блокировании роста и деления клеток организма. Одновременно используется антрациклиновый антибиотик. Как правило, такая терапия проводится за 7 дней, и в первые три дня вводится дополнительно антибиотик. Это позволяет добиться ремиссии (снижение количества больных клеток) в 70 – 80% случаев. Когда пациент входит в состояние ремиссии, проводится консолидационное лечение.
После курса химиотерапии раковые клетки становятся незаметны при диагностике, но в организме они остаются, и в конце концов почти у всех больных возникает рецидив. Чтобы этого не произошло, проводят дополнительную терапию.
У разных типов миелоидного лейкоза – разный прогноз возникновения рецидива. Медики смотрят на морфологические и цитогенетические показатели изменённых хромосом. Так как отдельные виды более предрасположены к рецидиву, пациентам назначают более интенсивные курсы.
В отношении прогноза для пожилых людей отмечается, что у 30 – 40% после консолидационного лечения возникает рецидив. У молодых, до 65 лет, рецидив возникает в 10 – 15% случаев. Это чаще всего связано с тем, что молодые люди лучше переносят лечение
Важно понимать, что статистика берётся среди всех случаев во всех возрастах
Пересадка костного мозга и рецидив
Если после консолидационного лечения рецидив всё-таки произошёл, то назначают пересадку стволовых клеток костного мозга от живого донора. Чаще всего это родственник больного. При таком лечении есть риск, что его стволовые клетки будут отторгнуты. После этого проводятся курсы интенсивной химиотерапии. При необходимости, с целью профилактики нейролейкоза, может применяться облучение ЦНС.
Прогноз возникновения рецидивов после пересадки стволовых клеток повышается до 40%.
На исход лечения также влияет время между рецидивами, врачи говорят о неблагоприятных прогнозах, если время между ними составляет менее одного года.
В целом можно сказать, что острый миелобластный лейкоз – излечимое заболевание, вы обязательно справитесь, удачи.
Терапия индукции
Цитотоксическая терапия острого миелобластного лейкоза вызывает транзиторную, но тяжёлую миелосупрессию с высоким риском инфекций и геморрагических осложнений. Спектр цитостатических препаратов, эффективных в отношении острого миелобластного лейкоза, достаточно невелик. Базовые препараты — цитозин-арабинозид, антрациклины (даунорубицин, митоксантрон, идарубицин), этопозид, тиогуанин.
Классически индукцию ремиссии острого миелобластного лейкоза проводят семидневным курсом. В течение всех 7 дней пациент получает цитозин-арабинозид в дозе 100-200 мг/(м2хсут), который в течение трёх дней комбинируют с даунорубицином в дозе 45-60 мг/(м2хсут). Большинство протоколов основано на этой классической схеме «7+3», к которой могут быть добавлены тиогуанин, этопозид или другие препараты. При применении таких терапевтических схем ремиссии достигают у 90% больных.
В 1989-1993 годах группа CCG провела исследование 589 детей с острым миелобластным лейкозом. Исследование показало преимущество индукции в режиме интенсивного тайминга. Суть этого режима в том, что больные получают индукционную терапию, состоящую из двух одинаковых 4-дневных курсов с интервалом 6 дней. Каждый курс лечения включает цитозин-арабинозид, даунорубицин, этопозид и тиогуанин. Необходимость повторения курса лечения строго через фиксированный интервал, независимо от показателей гемопоэза, обусловлена тем, что леикемические клетки, которые находились во время первого курса вне митотической фазы, войдут в неё ко времени начала второго курса и подвергнутся цитотоксическому воздействию химиопрепаратов. Преимущество интенсивного тайминга в достоверном увеличении EFSc 27% у больных, получавших ту же терапию в стандартном режиме, до 42%. В настоящее время группа CCG опубликовала данные о пилотном исследовании индукции интенсивного тайминга с использованием идарубицина, показаны преимущества этого препарата в терапии индукции у детей.
Группа MRC в исследовании AML-9 (1986 год) показала преимущества продлённой терапии индукции (5-дневную индукцию с применением даунорубицина, цитозин-арабинозида и тиогуанина сравнивали с 10-дневной). Несмотря на более высокий уровень смертности от токсичности (21 против 16%), уровень достижения ремиссии был выше в группе продлённой терапии. Следующее исследование этой группы — AML-10 — включало 341 ребёнка. Индукционная терапия в AML-10 была основана на стандартных дозах цитозин-арабинозида и даунорубицина с добавлением трегьего препарата — этопозида или тиогуанина, в зависимости от группы рандомизации. Индукция в AML-12 (в исследование включены 529 детей) состояла из схемы ADE (цитозин-арабинозид + даунорубицин + этопозид), в другой группе рандомизации — из схемы АМЕ (цитозин-арабинозид + митоксантрон + этопозид). Ремиссия в обоих исследованиях составила 92%, смерть в индукции и резистентные острые миелобластные лейкозы — по 4%. Уровень ремиссии в обеих ветвях протокола AML-12 (ADE и АМЕ) был практически одинаковым — 90 и 92%. В начале 1990-х годов DFS при остром миелобластном лейкозе увеличилась с 30 до 50%; с 1995 года (протокол AML-12) значение данного показателя составляет 66%.
Индукция по протоколу исследовательской группы LAME состоит из стандартных доз цитозин-арабинозида и митоксантрона (суммарная доза 60 мг/м2), ремиссия достигнута у 90% больных.
В России наиболее хорошо известны протоколы группы BFM. До 1993 года индукционная терапия состояла из курса ADE (цитозин-арабинозид + даунорубицин + этопозид). Согласно протоколу AML-BFM-93 (исследование включает 471 ребёнка), индукционная терапия в одной группе рандомизации была прежней — ADE, в другой группе — состояла из цитозин-арабинозида, этопозида и идарубицина. Уровень достижения ремиссии среди всех пациентов составил 82,2%. Показано, что введение идарубицина достоверно увеличило редукцию бластов у пациентов к 15-му дню от начала индукционной терапии, однако это не повлияло на частоту досгижения ремиссии и DFS, которая в этих группах была сходной.