Иммунная система: что это, ее органы и функции
Содержание:
- Эффективные вакцины
- «Есть ли у иммунной системы единое управление? Это пока дискуссионный вопрос»
- Широкие горизонты системной иммунологии
- №5. Например
- Лимфоциты
- Виды иммунитета
- Нейтрофилы
- Диета влияет на эффективность клеток CD8+
- Центральные органы иммунной системы
- Моноциты
- Функции иммунитета
- Какие заболевания не страшны при врождённом иммунитете?
Эффективные вакцины
Часть современных вакцин рассчитана не только на выработку антител, но и на формирование клеточного иммунитета, отметил директор научно-клинического центра прецизионной и регенеративной медицины Института фундаментальной медицины и биологии КФУ Альберт Ризванов. С этой точки зрения наработки коллег важны не только с точки зрения понимания фундаментальных процессов, но и имеют практическое значение.
— Вакцина «Спутник-V», а также вакцины Pfizer и Moderna должны хорошо работать не только для получения антител, но и для стимуляции клеточного иммунитета, рассказал ученый. -– Они приводят к тому, что клетки сами начинают производить вирусные белки-антигены и провоцируют такую реакцию на антиген, которая бы произошла при естественном заражении. Такого обычно не происходит при использовании, например, ослабленных рекомбинантных или инактивированных вирусных вакцин.
Тело без антитела
 Фото: РИА Новости/Георгий Зимарев
Фото: РИА Новости/Георгий Зимарев
Выводы исследования подтверждают гипотезы о достаточно большом количестве людей, у которых нет антител к SARS-CoV-2, но есть Т-клеточный иммунитет, подчеркнул руководитель лаборатории геномной инженерии МФТИ (вуз-участник проекта повышения конкурентоспособности образования «5-100») Павел Волчков.
— К сожалению, выборка в этой работе такая маленькая, что она не дает нам возможности сделать выводы о том, какой процент в нашем обществе уже защищен таким образом от COVID-19, — отметил он.По словам эксперта, если анализ на Т-клеточный иммунитет подтверждает его наличие, то, с точки зрения иммунологии, он должен защищать человека при следующей встрече с коронавирусом. Но этот факт тоже еще нужно доказать.
— Если бы я был автором этой статьи, я бы сформировал большой пул таких людей с Т-клеточным иммунитетом, за которыми бы наблюдал длительное время. Во-первых, интересно, заболеют они COVID-19 или нет. А во-вторых, я бы попробовал последить, какое количество Т-клонов у них останется в кровотоке через некоторое время, — рассказал Павел Волчков.
Результаты работы, поддержанной Российским научным фондом (РНФ), опубликованы в журнале Immunity (Cell Press).
«Есть ли у иммунной системы единое управление? Это пока дискуссионный вопрос»
— Может ли иммунная клетка осознавать свои действия?
— Такой вопрос был поставлен еще перед Мечниковым. Современная иммунология началась немногим более ста лет назад, когда был открыт фагоцитоз. Известно поэтическое описание фагоцитоза, когда Мечников воткнул шип в тело морской звезды и увидел собравшиеся вокруг раны клетки. Но тогда все было не так просто, как нам кажется теперь. В то время борьбы с религией перед ним был поставлен вопрос: «Защита — это прерогатива высших организмов. Мы можем защищать потомство, животные тоже. То есть вы хотите сказать, что клетки обладают функцией разума, могут действовать целесообразно?». И на этот вопрос Мечников смог ответить не прямо, а лишь косвенно. Как биолог-эволюционист, он показал, что фагоцитоз не «дар божий», он появился на определенных этапах эволюции живых организмов. А во-вторых, пришло на помощь внутриклеточное пищеварение: фагоцит — это заглатывающая клетка. Это помогло Мечникову обойти сложный вопрос о «целеполагании» в иммунологии.
Но многие категории иммунологии до сих пор существуют в «научном бессознательном». Есть, например, понятие «лимфоцит-киллер». До недавнего времени оно было известно только иммунологам, сейчас все могут понять, что это лимфоцит, который убивает внедрившийся микроорганизм, но при этом его не съедает. Зачем же он это делает? Может ли иммунная клетка действовать целесообразно — в интересах всего организма или других клеток, которые съедят остатки «пришельца» и поделятся с ней? Эти аспекты поведения иммунных клеток нуждаются в выводе из «научного бессознательного» и моделировании. А то нередко мы сами изобретаем иммунные функции и изучаем не то, что есть на самом деле, а какие-то наши собственные, возможно, иллюзорные представления об иммунитете.
— У иммунной системы есть единое управление?
— Это вопрос, о котором ученые до сих пор спорят. В иммунной системе есть своя иерархия, но не такая строгая, как в нервной системе, где имеется головной мозг, спинной мозг, периферический нервный аппарат. С нервной системой все понятно, и во многом иммунологи, изучая иммунитет, принимали ее в расчет. Что касается иммунной системы, ясно одно: есть подвижные клетки, которые мигрируют по всему организму, в результате выделения цитокинов могут собираться в одном или другом месте, а есть иммунные органы, где эти клетки созревают — костный мозг, где созревают лимфоциты, продуцирующие антитела, и есть вилочковая железа, где созревают Т-лимфоциты (тимусные) — «контролирующие» клетки приобретенного иммунитета. Прохождение через тимус — это «обучение», чтобы иммунная система вела себя прилично и не убивала собственные клетки, не развивала гипериммунный ответ, от которого человек может погибнуть.
Но существует ли такое постоянное управление иммунитетом из единого центра, каковым для нервной системы является головной мозг, пока еще вопрос дискуссионный. По крайней мере иммунная система из всех регуляторных систем наиболее подвижна. То есть, видимо, ее управление диктуется конкретной ситуацией.
Матвей Антропов
Справка
Марк Головизнин — кандидат медицинских наук, доцент кафедры внутренних болезней стоматологического факультета МГМСУ им. А.И. Евдокимова, член Совета ассоциации медицинских антропологов. Сфера научных интересов: иммунология, интердисциплинарные исследования, медицинская антропология.
ОбществоМедицина
Широкие горизонты системной иммунологии
Так получилось, что оба упомянутых в статье стипендиата работают над задачами, связанными с репертуаром Т-клеточных рецепторов. Но это далеко не единственная область иммунологии, где применяются методы системной биологии. Одни ученые собирают и упорядочивают информацию о сигнальных путях иммунных клеток — чтобы использовать ее при анализе разнообразных омиксных данных. Другие строят математические модели, описывающие поведение лимфоцитов. Третьи используют технологии «распознавания образов» (image recognition) для того, чтобы углубить наше знание о взаимодействии иммунных клеток. И это далеко не полный перечень тем и подходов, которые используют иммунологи сегодня. Своими соображениями о будущем системной иммунологии и самых интересных задачах, стоящих перед этой наукой, с нами поделился старший научный сотрудник ИБХ РАН Иван Звягин (рис. 4):

, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН и зав. лабораторией механизмов иммунотолерантности НИИ трансляционной медицины РНИМУ им. Н.И. Пирогова
«В современной иммунологии есть интереснейшие направления, где алгоритмы анализа больших “иммунологических” и вообще “биологических” данных играют главенствующую роль, так как на их основе можно создавать инструменты, предсказывающие те или иные иммунологические явления и позволяющие манипулировать иммунным ответом в нужном направлении.
В частности, на данный момент мы плохо понимаем, каким образом в каждом конкретном случае происходит связывание Т-клеточного рецептора с комплексом пептид—МНС (pMHC, peptide-loaded major histocompatibility complex), которое приводит к активации Т-лимфоцитов.
Если мы научимся предсказывать силу связывания TCR с тем или иным pMHC на основе их аминокислотных последовательностей, это позволит понять, чем определяется иммуногенность того или иного антигена. В сочетании со знаниями о закономерностях формирования репертуара распознающих рецепторов, это даст возможность разработать алгоритмы для предсказания оптимальных эпитопов для выработки нужного иммунного ответа против новых инфекций или терапии опухолей, оценки риска распознавания “своего” и рационального дизайна узнающей части рецепторов при совершенствовании способов клеточной терапии (например CAR-T-терапия ).
С другой стороны, те же алгоритмы будут задействованы и в направлении создания неиммуногенных вариантов белковых последовательностей, когда это важно — например при генотерапии. Ответы на все эти вопросы — дело ближайшего будущего
Полученные данные и созданные алгоритмы в дальнейшем позволят разрабатывать способы рационального дизайна иммунной системы, исходя из особенностей конкретного человека, с целью снижения риска развития заболеваний и увеличения продолжительности активной жизни»
Ответы на все эти вопросы — дело ближайшего будущего. Полученные данные и созданные алгоритмы в дальнейшем позволят разрабатывать способы рационального дизайна иммунной системы, исходя из особенностей конкретного человека, с целью снижения риска развития заболеваний и увеличения продолжительности активной жизни».
№5. Например
Чтобы было понятнее, вот вам пример: обыкновенные юношеские бородавки (на самом деле вирус папилломы человека третьего типа).
- В микротравму кожи (царапина, потёртость) проникает вирус, постепенно проникает дальше в глубокие слои поверхностного слоя кожи. В организме человека ранее ещё его не было, поэтому иммунная система человека ещё не знает, как надо на него реагировать.
- Вирус встраивается в генный аппарат клеток кожи, и они начинают неправильно расти, принимая уродливые формы.
- Таким образом формируется бородавка на коже. Но этот процесс не проходит мимо иммунной системы. Первым делом включаются Т-хелперы. Они начинают распознавать вирус, снимают с него информацию, но уничтожить его сами не могут, так как его размеры очень малы, а Т-киллер могут убить только более крупные объекты типа микробов.
- Т-лимфоциты передают информацию В-лимфоцитам, и те начинают выработку антител, которые проникают через кровь в клетки кожи, связываются с частичками вируса и таким образом обездвиживают их, а затем весь этот комплекс (антиген-антитело) выводится из организма.
- Т-лимфоциты передают информацию о заражённых клетках макрофагам. Те активизируются и начинают постепенно пожирать измененные клетки кожи, уничтожая их. А на месте уничтоженных постепенно нарастают здоровые клетки кожи.
Лимфоциты
При невозможности макрофагов самостоятельно справиться с возбудителем в очаг проникновения посылаются по сигналу Т-лимфоциты, Т-хелперы. Т-хелперы обладают способностью производить одни и мобилизовать другие мощные элементы иммунной системы.
Однако перед тем, как Т-хелпер начинает действовать, он должен получить информацию о присутствии конкретного антигена – бактерии, вируса, чужеродного белка или раковой клетки. Получив сигнал тревоги, Т-хелпер приступает к активизации защитных сил организма. Лишь Т-хелперы способны мобилизовать все силы организма на борьбу с инфекцией.
Реакция Т-хелпера на антиген не происходит автоматически. На поверхности хелпера должен быть специальный рецептор, который точно соответствует антигену, как ключ к замку. Каждый Т-хелпер способен опознать характерные черты лишь своего антигена, но этого вполне достаточно для организации иммунного ответа. Считается, что на миллионы посланий макрофагов реагирует лишь небольшая часть Т-хелперов. У остальных нет специфического рецептора для этого антигена. Рецепторы же на каждом Т-хелпере формируются по команде генов, одинаковых для всех лимфоцитов. Каждая клетка строит свой рецептор на основе генетической матрицы из обширного набора, предлагаемого генами. Обучение лимфоцитов происходит в тимусе (вилочковой железе). Именно там Т-хелперы приобретают специфический рецептор, принимая на себя часть ответственности за иммунный ответ. Как только Т-хелпер получает свой рецептор, он выходит в кровь, готовый к встрече со своим врагом. Через некоторое время лимфоцит разделяется, и его потомство будет обладать тем же рецептором. Если в организм попадут бактерии или вирус, члены этого семейства или клана разбредутся по всему организму и узнают своего врага в любой ткани, в каждом органе.
Важно подчеркнуть, что каждый возбудитель той или иной болезни несет не один, а несколько антигенов, поэтому шансы иммунной системы в опознании врага высоки. Достаточно хелперу опознать своего врага, как он развивает бурную активность
По его сигналу миллионы и миллионы иммунных клеток занимают свои позиции и начинают действовать. Человек в это время чувствует себя дискомфортно: слабость, разбитость, боли, потливость… А в это время все ресурсы организма включаются по сигналам иммунной системы в борьбу с недугом. В работу включаются клетки-киллеры, еще один вид белых кровяных клеток, которые способны убивать бактерии, вирусы и раковые клетки. И все это время иммунная система постоянно учится на собственном опыте, запоминая удачные варианты иммунного ответа, потому при следующей встрече с антигеном у нее будет готовый и организованный план действий.
Если Т-лимфоциты оказываются ослабленными или поврежденными (например, как при заболевании СПИДом), возможности иммунной системы будут неполные, и потому в случае попадания в организм инфекции сопротивление будет осуществлено недостаточно или вовсе ослаблено, приводя к необратимым последствиям.
Если только Т-хелпер узнал антиген, он начинает размножаться, чтобы по организму разошлось как можно больше лимфоцитов с таким же рецептором. И тогда по всему организму распространяются клетки, способные опознать чужеродный микроорганизм, проникший в тело человека.
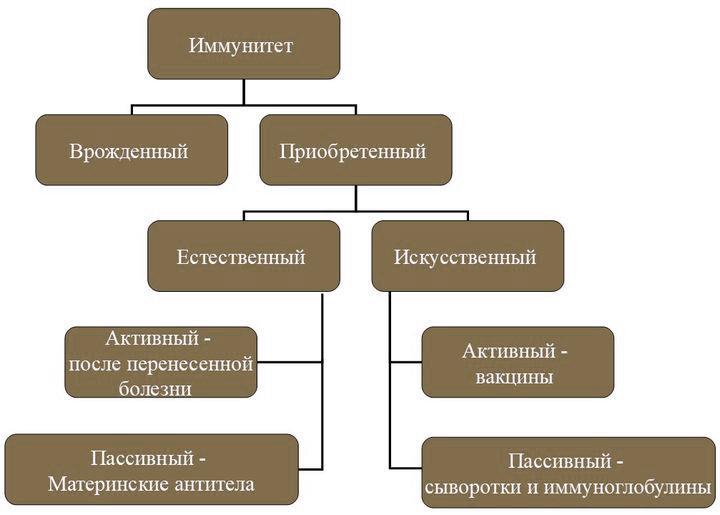
Виды иммунитета
Существует несколько классификаций иммунитета, каждая из которых имеет свои особенности и отличия.
Врожденный (видовой, наследственный, генетический)
Его характеризует то, что выработанная в филогенезе и передающаяся по наследству устойчивость к инфекции обусловлена биологическими особенностями самого организма. Например, человек не болеет некоторыми опасными болезнями свиней лошадей и других животных, а также не чувствителен к действию бактериофагов. Врожденный иммунитет, в свою очередь, может быть абсолютным и относительным. К примеру, если лягушка не имеет чувствительности к столбнячному токсину, то при увеличении температуры её тела можно увидеть иммунную реакцию.
Приобретенный
Представляет собой комплекс защитных реакций, приобретенных в процессе онтогенеза из-за переменных заболеваний (естественный) или после вакцинации (искусственный). После первой встречи с антигеном организм “запасается” готовыми антителами, поэтому при его повторном попадании внутрь происходит менее яркий ответ или человек вовсе не ощущает ухудшение самочувствия. Наиболее ярким примером является ветряная оспа. Переболев ей однажды, подавляющее большинство не заразится ветрянкой снова, даже при тесном контакте с больным. Это пример естественной защиты. Искусственный иммунитет формируется после проведения прививок (корь, краснуха, столбняк и т.п.), суть которых заключается во введении ослаблений или убитой вакцины, способствующей формированию антител.
Гуморальный
Он связан с выработкой антител. В-лимфоциты — это молекулы иммуноглобулинов, которые активируется при контакте с антигеном. Они начинают активно делиться и дифференцироваться в лимфоузлах в плазматические клетки. Часть из них трансформируется в клетки памяти, отвечающие за быструю реакцию на повторное проникновение.
Клеточный
Он отвечает за образование специализированных клеток, обеспечивающих связываема и дальнейшее уничтожение патогена. Иммунный ответ опосредован Т-лимфоцитами и Т-хелперами. Первые контактируют с патогенетическим агентом, разрушают их, а вторы вырабатывают цитокины, участвующие в активации макрофагов.
Нейтрофилы
Первое самое многочисленное звено защитных клеток представлено нейтрофилами. Их популяция составляет около семидесяти процентов от числа всех лейкоцитарных тел, при этом молодые нейтрофилы палочкоядерного типа — полтора процента, а остальные зрелые виды.
Нейтрофильные тельца — это полиморфоядерные гранулоцитарные представители лейкоцитов, имеющие ядро состоящее из сегментов. Они являются представителями фагоцитов. В осуществлении фагоцитарной функции действуют как микрофаги, и способны распознавать, прикрепляться и поглощать мелкие патогенные частицы. Закончив фагоцитоз, нейтрофилы погибают, производя дегрануляционные процессы и усиливая миграцию иммунных клеток в очаг инфекции.
Нейтрофилы выполняют иммунологические функции в борьбе с болезнетворными бактериями и грибками, принимают участие в противовирусном ответе, а в противопаразитарном и противоопухолевом иммунитете не участвуют.
Изменение уровня нейтрофилов в крови говорит о наступлении иммунных реакций на проникновение бактериальных и других инфекций, но при хронических заболеваниях их уровень остается в пределах нормы.

Диета влияет на эффективность клеток CD8+
Исследователи обнаружили, что опухоли росли гораздо быстрее у тех животных, кто был на диете с высоким содержанием жиров, по сравнению с теми, кто ел обычную пищу. Но это произошло только в тех видах рака, которые являются иммуногенными, которые могут содержать большое количество иммунных клеток; которые легче распознаются иммунной системой; и с большей вероятностью провоцируют иммунный ответ.
Эксперименты показали, что различия в росте опухоли, связанные с питанием, зависят в частности от активности иммунных CD8+ Т-клеток, которые могут нацеливаться и убивать раковые клетки. Диета не влияла на скорость роста опухоли, если CD8+ Т-клетки были удалены у мышей в ходе эксперимента.
Поразительно, что пища с высоким содержанием жиров уменьшала присутствие CD8+ Т-клеток в микроокружении опухоли, но не в других частях тела. Оставшиеся в опухоли иммунные клетки были менее устойчивы – они делились медленнее и имели маркеры пониженной активности. Но когда эти клетки были изолированы и выращены в лаборатории, то они показывали нормальную активность, что означает – что-то в опухоли нарушило функционирование этих клеток.
Группа ученых также столкнулась с очевидным парадоксом. У животных с ожирением микроокружение опухоли было истощено ключевыми свободными жирными кислотами, основным источником клеточного топлива, хотя остальная часть тела была обогащена жирами, как и ожидалось при повышенном весе тела.
Эти данные подтолкнули исследователей к созданию атласа метаболических профилей различных типов клеток в опухолях в условиях нормальной и высокожировой диеты.
Анализы показали, что раковые клетки адаптируются в ответ на изменения в питании. При диете с высоким содержанием жиров раковые клетки могли перепрограммировать свой метаболизм, чтобы увеличить поглощение и утилизацию жира, в то время как CD8+ Т-клетки этого не делали. Это в конечном счете истощало микроокружение опухоли определенными жирными кислотами, оставляя Т-клетки “голодными” без такого необходимого топлива.
“Парадоксальное истощение количества жирных кислот было одним из самых удивительных результатов этого исследования. Это действительно поразило нас, и это была стартовая площадка для наших анализов“, – сказал Рингель, аспирант в лаборатории Хейгиса. “То, что ожирение и метаболизм всего тела могут изменить то, как различные клетки в опухолях используют энергию жира, было захватывающим открытием, и наш метаболический атлас теперь позволяет нам анализировать и лучше понимать эти процессы.”
 Витамин D контролирует рост опухоли рака молочной железы и проникновение CD8+ Т-клеток в опухоль. (источник)
Витамин D контролирует рост опухоли рака молочной железы и проникновение CD8+ Т-клеток в опухоль. (источник)
Центральные органы иммунной системы
Центральными
органами иммунной системы являются
костный
мозг и
вилочковая
железа (тимус).Это
органы
воспроизведения и селекции
клеток иммунной системы. Здесь происходит
лимфопоэз—
рождение, размножение
(пролиферация)
и дифференцировка
лимфоцитов
до стадии предшественников или зрелых
неиммунных (наивных) клеток, а также их
«обучение».
Внутри тела человека эти органы имеют
как бы центральное расположение.
У птиц
к центральным органам иммунной системы
относят сумку Фабрициуса (bursaFabricii),
локализованную
в области клоаки. В
этом органе происходит созревание и
размножение
популяции лимфоцитов — продуцентов
антител, вследствие чего они получили
название
В-лимфоциты
У
млекопитающих этого анатомического
образования
нет, и его функции в полной мере выполняет
костный мозг. Однако традиционное
название «В-лимфоциты» сохранилось.
Костный
мозглокализуется
в губчатом веществе костей
(эпифизы трубчатых костей, грудина,
ребра
и др.). В костном мозге находятся
полипотентные стволовые клетки, которые
являются родоначальницами
всех форменных элементов крови и,
соответственно, иммунокомпетентных
клеток. В
строме костного мозга происходит
дифференцировка и размножение
популяции
В-лимфоцитов,
которые затем разносятся по всему
организму кровотоком.
Здесь же образуются предшественники
лимфоцитов,
которые впоследствии мигрируют
в тимус, — это популяция Т-лимфоцитов.
Фагоциты
и некоторые дендритные клетки также
образуются
в костном мозге. В нем можно обнаружить
и плазматические
клетки.
Они образуются на
периферии в результате терминальной
дифференцировки
В-лимфоцитов, а затем мигрируют назад,
в костный мозг.
Вилочковая
железа, или
тимус,
или
зобная
железа,
располагается
в верхней части загрудинного
пространства. Этот
орган отличает особая динамика
морфогенеза. Тимус появляется в
период внутриутробного развития. К
моменту рождения
человека его масса составляет 10—15 г,
окончательно
он созревает к пятилетнему возрасту,
а максимального размера достигает к
10-12
годам жизни (масса 30—40 г). После периода
полового
созревания начинается инволюция органа
— происходит замещение лимфоидной
ткани
жировой и соединительной.
Тимус
имеет дольчатое строение. В его структуре
различают
мозговой и корковый слои.
В
строме коркового слоя
находится большое
количество эпителиальных клеток коры,
названных «клетки-няньки», которые
своими
отростками образуют мелкоячеистую
сеть, где располагаются «созревающие»
лимфоциты.
В пограничном, корково-мозговом слое
располагаются дендритные клетки тимуса,
а
в мозговом — эпителиальные клетки
Предшественники
Т-лимфоцитов, которые
образовались
из стволовой клетки в костноммозге,
поступают в корковый слой тимуса.
Здесь
под влиянием тимических факторов
они активно размножаются и дифференцируются
(превращаются) в зрелые Т-лимфоциты,
а
также
«учатся» распознавать чужеродные
антигенные
детерминанты.
Процесс
«обучения» состоит из двух этапов,
разделенных
по месту и времени, и
ивиочает
«положительную»
и
«отрицательнуюселекцию.
Положительная
селекция.
Суть ее заключается в «поддержке» клонов
Т-лимфоцитов,
рецепторы которых эффективно
связались с экспрессированными
на эпителиальных клетках собственными
молекулами
МНС, независимо от структуры
инкорпорированных
собственных олигопептидов.
Активировавшиеся в результате контакта
клетки получают от эпителиоцитов коры
сигнал на выживание и размножение
(ростовые
факторы тимуса), а нежизнеспособные или
ареактивные клетки погибают.
«Отрицательную»
селекциюосуществляют
дендритные
клетки в пограничной, корково-мозговой
зоне тимуса. Ее основная цель —
«выбраковка» аутореактивных клонов
Т-лимфоцитов.
Клетки, позитивно реагирующие на комплекс
МНС-аутологичный пептид, подвергаются
уничтожению путем индукции у них
апоптоза.
Итоги
селекционной работы в тимусе весьма
драматичны: более 99 % Т-лимфоцитов не
выдерживают
испытаний и погибают. Лишь менее
1 % клеток превращается в зрелые не-иммунные
формы, способные распознать в комплексе
с аутологичными МНС только чужеродные
биополимеры. Ежесуточно около 106
зрелых «обученных» Т-лимфоцитов покидают
тимус с крово- и лимфотоком и мигрируют
в различные органы и ткани.
Созревание
и «обучение» Т-лимфоцитов в тимусе
имеют важное значение для формирования
иммунитета. Отмечено, что эссенциальное
отсутствие или недоразвитие тимуса
ведет к резкому
снижению эффективности иммунной защиты
макроорганизма
Такое явление наблюдается
при врожденном дефекте развития
вилочковой
железы — аплазии или гипоплазии
Моноциты
Крупные лейкоцитарные клетки мононуклеарныго типа — это моноциты. После их синтеза красным косным мозгом, они циркулируют по кровеносной системе не более сорока часов и уходят в тканевые сплетения, где становятся гистиоцитами соединительно-тканного аппарата, печеночными купферовскими телами, макрофагами альвиол, селезенки, костного мозга, лимфатической системы.
Для них характерны функциональные свойства:
- Выполняют фагоцитную функцию;
- Способствуют очищению очагового места воспаления и крови от антигенов;
- Синтезируют секреторные вещества и медиаторы;
- Способствуют росту фибропластов, белковых соединений комплимента;
- Создают условия для успешной регенерации тканей, после уничтожения патогена.
Функции иммунитета
Иммунная система человека — это слаженный механизм, создающий барьер для пагубного воздействия как внешних, так и внутренних факторов. У здорового человека она невосприимчива не только к инфекциям, микробам, бактериям, но и к инородным организмам, не имеющим одинаковый генетический код с человеческим организмом. Иммунитет, с биологической точки зрения, сохраняет оптимальное постоянство среды внутри тела и защищает от внешних пагубных факторов, в том числе и простейших гельминтов.
Если говорить кратко, то иммунитет – это система, не позволяющая проникать инфекциям и бактериям, а также способ защиты от развития опасных патологий – онкологии, воспалительных и аутоиммунных процессов. Именно по этой причине, на ранках, царапинах, ссадинах, местах проведения операций и других пораженных зонах происходит быстрое заживление, восстановление после болезней.
Иммунитет – это система определения опасности, которая возникла вместе с появлением многоклеточных организмов для того, чтобы помочь им выжить. Она имеет свойство распознавания чужаков, вызывающих опасные патологии для организма. Распознавание происходит на генетическом уровне, так как любая клетка обладает информацией. Врачи называют данное свойство «меткой».

Клетки иммунной системы. Фото: yandex.ru
Какие заболевания не страшны при врождённом иммунитете?
Врождённый в процессе жизни не меняется. Имеет видовую предрасположенность. Это значит, что человек определёнными заболеваниями заболеть не сможет. Такой же иммунитет есть у животных, птиц и рептилий.
К таким заболеваниям как чума рогатого скота – человек не восприимчив. Например, птицы не болеют птичьим гриппом. В свою очередь кошки или собаки не восприимчивы к менингиту, кори, другим человеческим заболеваниям.
Так же существует факт, что некоторые люди не болеют ВИЧ и туберкулёзом. Этот вирус способен поразить человека, по-другому инфицировать. Но не вызывать симптомом. Такое происходит из-за генетической мутации. Около 2% европейских людей устойчивы к ВИЧ или имеет замедленный рост этого вируса. Так же многие знают эпидемию чумы в средневековье. Но сейчас мы ей так не болеем. Врождённый иммунитет способен меняться и эволюционировать. Все новые антигены могут передаваться в генах.
Сегодня в мире эпидемия раковых заболеваний. Это заболевание примечательно тем, что возникает почти случайно. Даже у одинаковых близнецов, находящихся в одних и тех же условиях, может быть, что одного близнеца может появиться раковая опухоль. А у второго нет.
Ученые заметили и наследственную предрасположенность. Давно доказано, что образ жизни влияет на развитие раковой опухоли. 70% людей есть доброкачественная опухоль. Но развивается в злокачественную только у 30%. Одна из теорий учёных – это из-за внутреннего иммунитета.
На данный момент до конца свойства защитных систем организма не изучены. Сказать точно почему некоторые люди болеют, а другие нет, точно сказать нельзя.